


私たちを形作る細胞は、変形・運動・分裂といった動的な変化を見せます。この動きは、細胞の主要な構成要素の 1 つであるタンパク質のうち、細胞骨格タンパク質とよばれる生体分子と、モータータンパク質とよばれる別の生体分子の連携によって生み出されることが知られています。この細胞骨格タンパク質であるアクチン分子、そしてモータータンパク質であるミオシンは、細胞の大きさに比べると非常に小さなものですが、分子同士が相互作用して集合体になることで、細胞内に流れや力を生み出し、細胞内の構造物の配置を制御していると考えられています。従来の生命科学では、主として新たなタンパク質の発見や、生化学反応の詳細な理解が進められてきました。近年では、力など物理的な要素が関わることが注目され、物理学と生命科学の双方からの理解が求められています。しかし、生きた細胞は非常に複雑であるために、このような構造形成の仕組みを物理的な観点から理解するには、十分な実験手法が発達していませんでした。そこで、物理学専攻 複雑流体研究室の坂本さんらは、実際の細胞を単純化した人工細胞を作成することで、このメカニズムについて研究を行いました。人工細胞は、サイズ・形状・タンパク質濃度などを容易に変えることができるため、生命現象を物理的な観点から調べる上で好都合です。この研究では、人工細胞内部の球形の構造物が、人工細胞の大きさに応じて配置場所を変化させる現象を見出し、アクチンとミオシンによる力の綱引きが重要な役割を果たしていることを明らかにしました。この研究成果は、Nature Communications に掲載されています。
私たち人間や動物、植物、微生物など全ての生物は、細胞によって構成されています[1]。細胞が動く際には形を変えながら力を出して前に進み、細胞が分裂するためにも力を出しながら 2 つの娘細胞に分かれていきます。これらの動的な変化にはタンパク質が自ら力を発揮する仕組みが重要であり、細胞内に含まれている細胞骨格タンパク質の一種であるアクチンが関わっています。アクチンは細胞内で互いに連結して繊維状になり、アクチン繊維とよばれる構造を形成しています[2]。そして、細胞が力をうみだすためにもう一つの重要なタンパク質はミオシンとよばれるモータータンパク質です。ミオシンはアクチン繊維と結合することで、アクトミオシンという構造を作り[3]、その収縮力で細胞を運動させたり分裂させたりします (図1) 。
![クリックやタップで拡大 <dfn class="fig">図1</dfn>:<span class="qrinews-figure-title">本稿で登場する細胞内のタンパク質</span> [a] 細胞が分裂する様子。アクチンタンパク質 (紫色) を可視化している。写真は坂本さんより提供。 [b]本稿で登場するタンパク質の一覧。図は坂本さんより提供。](images/200930/fig1-3055b3bc.png)

アクチンやミオシンの大きさは nm サイズであるため、数十 μm サイズの細胞に比べると 1000 倍以上小さいですが、多数のアクチンとミオシンが集合したアクトミオシンは、細胞サイズに匹敵する細胞骨格構造をとることができます。このアクトミオシンが力を生み出すことによって、細胞の変形・分裂を引き起こし、ときには細胞内部に流れを生み出し、またあるときには細胞核の配置を決めるなど、様々な場面で細胞の構造と機能を制御する重要な役割を担っていることが知られています。
ここで、細胞内の構造について、「対称性」という幾何学の観点から整理してみましょう。例えば、受精後の受精卵の多くは、できたばかりの細胞核が細胞の中心位置に運ばれます。受精卵が球の形をもち、核がその中心にあることで対称的な配置になります。一方、1 つの受精卵から私たちの生体が出来上がる発生の過程では、細胞内のタンパク質が均一に広がるのではなく,片側に偏って非対称に分布することがあります。この非対称性は、将来的に体の前後の軸を定めるために重要であると考えられています。このように、細胞は内部の「対称性」と「非対称性」を使い分けて、複雑な生命現象をコントロールしているといえます。
生きた細胞を対象としたこれまでの研究では、細胞核の配置決めには、収縮力を生み出すアクチンとミオシンが関わっていることが報告されていました。しかし、生きた細胞にはこれらの分子以外にも多数の分子が含まれており、その複雑さゆえに、これまで十分な理解は得られていませんでした。また、細胞のサイズや形状を自由に変化させるのは容易ではないことも、これまで生きた細胞内での研究が十分なされていなかった理由の一つです。アクチンとミオシンは、どのようにして細胞の中心を知り、細胞内の構造を「対称に配置するか」と「非対称にするか」を選り分けているのでしょうか?
この問題に答えるために、坂本さんらは細胞のサイズや形状、細胞内のタンパク質濃度などを制御しやすい人工細胞を作成して実験を行いました。ここでいう人工細胞とは、細胞の特定の機能や構造を抽出し、細胞内部の環境を単純化したものです。
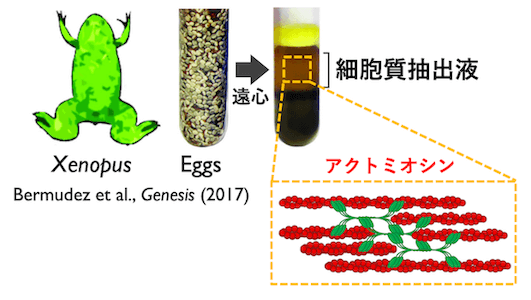
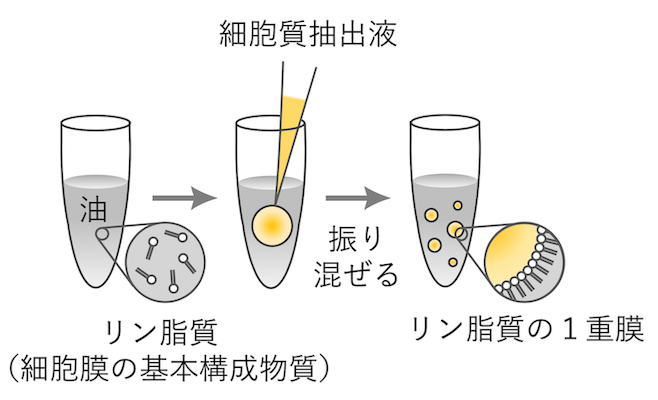
人工細胞の作成方法は以下の通りです。まずアフリカツメガエル (Xenopus laevis) の卵から細胞質抽出液を取り出します。細胞質抽出液にはアクチンとミオシン、そしてアクチン細胞骨格の形成に関わるタンパク質が含まれています (図2)。次に、細胞膜を構成する物質であるリン脂質を加えた油を用意します。この油の中に、先ほど取り出した細胞質抽出液を加え、振り混ぜます。すると、直径が数 μm から数百 μm までの様々な大きさを持った細胞質抽出液の液滴が油の中に分散します。このとき、抽出液の液滴のまわりにはリン脂質の膜が張り、細胞膜のような境界をつくります[4](図3)。この液滴が人工細胞と呼ぶものとなり、これを油相とともにスライドガラスの間に封入して、顕微鏡で観察します (図4)。温度を 20℃ まで上げると、人工細胞の中でアクチンとミオシンが集合し、アクトミオシンの収縮現象が開始します。
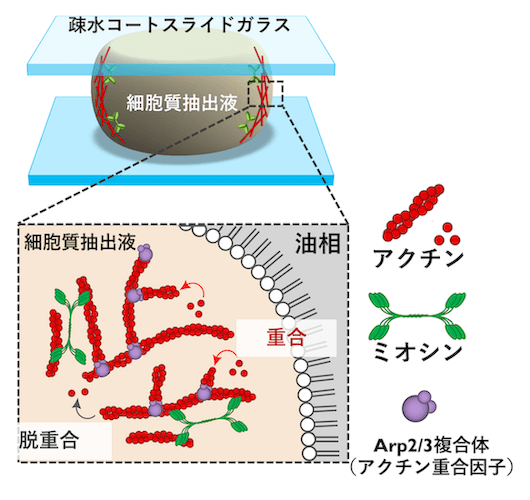

アクトミオシンが収縮を始めて最初の約 60 秒間は、アクトミオシンが人工細胞の中心に集まり、細胞核のようなクラスターを形成します (図5上)。その後、人工細胞の辺縁ではアクチン重合因子 (Arp2/3 複合体) によって新しいアクチン繊維がリング状に形成され、そのリングが人工細胞の中心へ向かって収縮します (図5下)。このリングの形成と収縮は周期的に起こり、アクトミオシンの波が発生していると考えることができます。


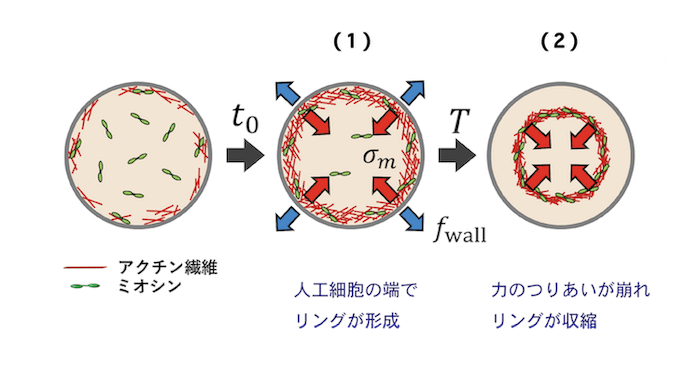
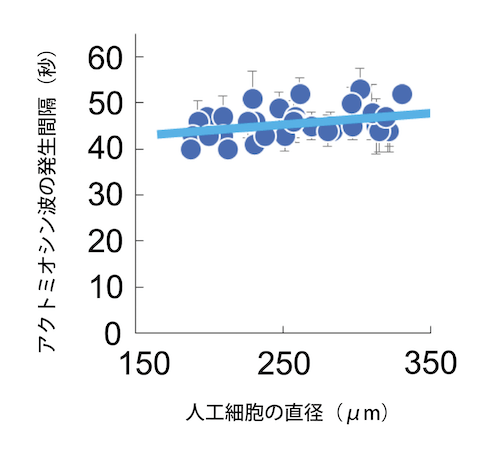
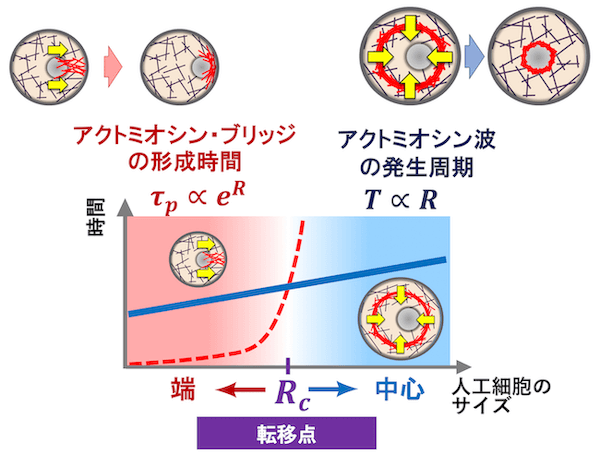
アクトミオシン波が発生するメカニズムは、以下のように考えられます (図6)。まず、(1) 人工細胞の壁面でアクトミオシンが繋がり、リングを形成します。このリング状のアクトミオシンは、伸ばされた輪ゴムが縮もうとするように収縮力を引き起こします。しかし、このリングは人工細胞の壁面に接着しており、接着による抗力(接着力)とつり合うために、すぐに収縮する訳ではありません。時間が経つにつれ、リング内のアクトミオシン濃度が上昇していき、縮もうとする力はどんどん大きくなります。ついには、(2) アクトミオシンのリングの収縮力に、壁面の接着力が耐えられなくなり、リングは中心に向かって収縮します。このような理由で、決まった時間間隔でリング状のアクトミオシンが収縮すると考えることができます。収縮力と接着力のつりあいを計算すると、アクトミオシン波の周期は、人工細胞のサイズ (直径) に比例して増大する[5]ことが予想され、実験結果と一致することが確認されました (図7)。以上の結果から、アクトミオシン波は人工細胞の中心方向に収縮力を生み出し、クラスターを中心へ運ぶ力を生み出していると考えられます。

 実験データは、解析してグラフにプロットして初めて一つの結果になります。解析にはそれなりに時間がかかるので、できるだけ効率を上げるために動画の作成や波の周期の解析で数値計算ソフトウェアの MATLAB を使って自動化を行いました。また、解析を自動化するためには、データも綺麗に取る必要があり、実験と解析を行うたびに相互に改善していきました。
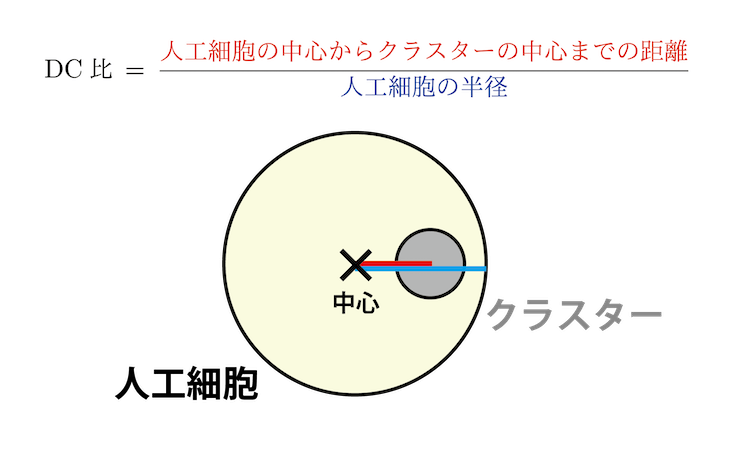
実験データは、解析してグラフにプロットして初めて一つの結果になります。解析にはそれなりに時間がかかるので、できるだけ効率を上げるために動画の作成や波の周期の解析で数値計算ソフトウェアの MATLAB を使って自動化を行いました。また、解析を自動化するためには、データも綺麗に取る必要があり、実験と解析を行うたびに相互に改善していきました。さらに、アクトミオシンのクラスターの配置を詳しく調べたところ、人工細胞の中心に配置される場合、または人工細胞の端に配置される場合の 2 つの状態がわかりました。サイズの大きい人工細胞ではクラスターは中心に、サイズの小さい人工細胞ではクラスターは端の方に配置されるという結果を得ました。この変化を詳細に解析するため、DC 比という量を導入します (図8)。DC 比とは、人工細胞の中心からアクトミオシンのクラスターの中心までの距離を、人工細胞の半径で割ったものです。もし DC 比が 0 に近ければ、クラスターは人工細胞のほぼ中心に位置していることを意味します。一方、DC 比が 1 に近づくとクラスターは人工細胞の端の方に配置されていることを意味します。
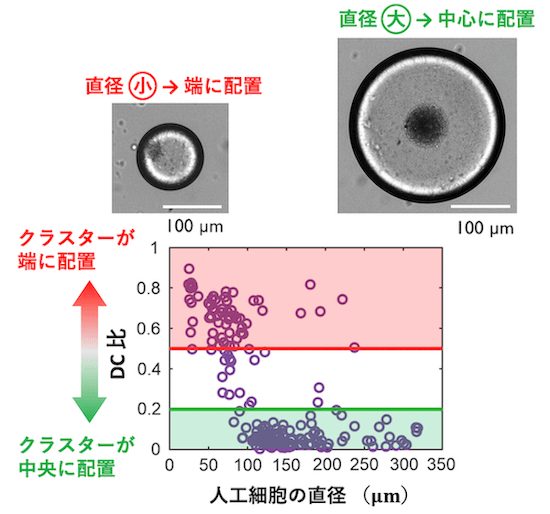
様々な大きさの人工細胞を大量かつ容易に作成できるという強みを生かし、直径 330μm までの人工細胞のサイズに対して DC 比をプロットしたものが図9に示されています。直径が大きい人工細胞ではクラスターの DC 比が 0 に近く、直径が小さい人工細胞では DC 比が 1 に近い値をとっています。すなわち、人工細胞のサイズが大きくなるにつれて、クラスターは端から中心へと配置される位置が変化することがわかります。ただし、この構造配置の変化は、人工細胞の大きさに応じてなめらかに変化するのではなく、ある直径(転移点)を境に急激に変化していることがわかります。

 人工細胞の大きさは、油と細胞質抽出液を入れた Tube (試験管) を振る強さである程度コントロールできます。今回の実験では広い範囲 (直径 16μm 〜 330μm) の大きさを調べたので、欲しいサイズの人工細胞をうまく作るために、力加減をうまく調整していきました。また、液滴のサイズとクラスターの中心からの距離は MATLAB による画像解析で抽出しますが、これらについても画像解析からグラフの出力までを全自動化することで、他の実験を行う合間に解析も進めるなどして効率化を図る工夫を凝らしました。早めに実験の解析結果を示すことにより、すぐに改善点などを議論し、次の実験に素早く反映することができました。
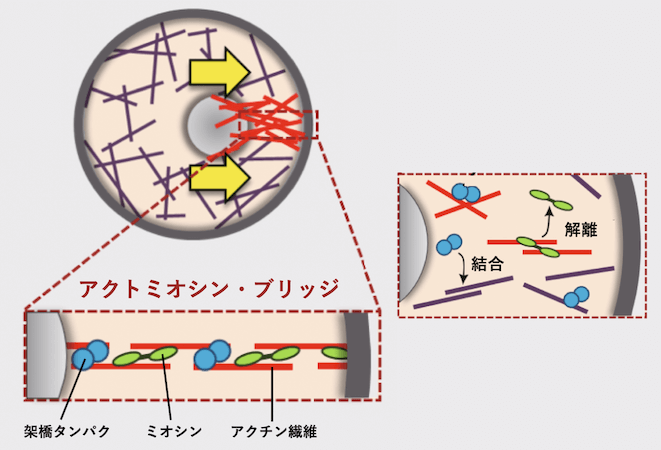
人工細胞の大きさは、油と細胞質抽出液を入れた Tube (試験管) を振る強さである程度コントロールできます。今回の実験では広い範囲 (直径 16μm 〜 330μm) の大きさを調べたので、欲しいサイズの人工細胞をうまく作るために、力加減をうまく調整していきました。また、液滴のサイズとクラスターの中心からの距離は MATLAB による画像解析で抽出しますが、これらについても画像解析からグラフの出力までを全自動化することで、他の実験を行う合間に解析も進めるなどして効率化を図る工夫を凝らしました。早めに実験の解析結果を示すことにより、すぐに改善点などを議論し、次の実験に素早く反映することができました。なぜ人工細胞のサイズが小さいと、クラスターは人工細胞の端に配置されるのでしょうか?人工細胞をよく観察すると、繊維状の構造が壁面とクラスターを繋ぎとめていることがわかりました(図10 a,b)。坂本さんは、これをアクトミオシン・ブリッジと呼んでおり、アクチン繊維が一つの束になってクラスターから人工細胞の端までつながったものと考えられます。アクトミオシン・ブリッジによりクラスターが人工細胞の端側に引き寄せられることも観察され、この構造体にはアクチンだけでなくミオシンも含まれて収縮力を発揮していることが示唆されました (図10 b)。
![クリックやタップで拡大 <dfn class="fig">図10</dfn>:<span class="qrinews-figure-title">アクトミオシン・ブリッジ</span> [a] 矢印の先にある黄色の線に沿った束状の構造がアクトミオシン・ブリッジである。アクトミオシン・ブリッジが人工細胞の端に向かってクラスターを引き寄せている(動画で見てみよう。<a href="https://www.nature.com/articles/s41467-020-16677-9" class="link-to-external-page" target="_blank"><cite class="article" lang="ja">Sakamoto et al. (2020) の論文ページ</cite></a> 下方の Supplementary information の項目の Supplementary Movie 12 をクリック)。写真は坂本さんより提供。[b] <a href="#fig5"><cite class="fig">図5</cite></a>と同様に、アクチン濃度分布を蛍光顕微鏡で可視化した。クラスターから人工細胞の壁面にかけて棒状の部分がアクトミオシン・ブリッジ (黄色) に相当する。<a href="https://www.kyushu-u.ac.jp/f/39550/20_06_15_02.pdf" class="link-to-external-page" target="_blank"><cite class="article" lang="ja">プレスリリース</cite></a>の図を改変。](images/200930/fig10-dc1af49a.png)

 ブリッジの形成を光学顕微鏡の解像度で撮影するのは、解像度の限界として難しかったですが、何度もトライすることである程度良いデータを取ることができました。また、以前撮ったデータなども丁寧に観察し、多くの人と議論することで、メカニズムについての考察を深めていくことができました。
ブリッジの形成を光学顕微鏡の解像度で撮影するのは、解像度の限界として難しかったですが、何度もトライすることである程度良いデータを取ることができました。また、以前撮ったデータなども丁寧に観察し、多くの人と議論することで、メカニズムについての考察を深めていくことができました。そして、アクトミオシン・ブリッジが形成されるメカニズムは、以下のように考えられます。人工細胞内にあるアクチン繊維は、ミオシンや他のアクチン架橋タンパク質を通じて、ある確率で隣のアクチン繊維と繋がります。一方で、互いに繋がった 2 本のアクチン繊維は一定の確率で結合が外れ、再び独立したアクチン繊維に分かれると考えられます (図11)。このとき、クラスターから人工細胞の壁面まで、多数のアクチン繊維が隙間なく一本に繋がり,中心から壁までを橋渡しする確率を求めることができます。その結果、人工細胞のサイズが大きいほど、中心から端まで途切れることなくアクチン繊維で繋げるために必要となる本数は増えていきます。そして、アクチン繊維が連結する過程は確率的に起こるとすると、人工細胞が大きくなるにつれてアクトミオシン・ブリッジが形成される確率は急激に低下することになります。言い換えれば、人工細胞のサイズが大きいほど、アクトミオシン・ブリッジが形成されるまでにかかる時間は長くなるのです。この計算により、アクトミオシン・ブリッジが形成されるまでの時間は、人工細胞の直径に対して指数関数的に増大する[6]ことがわかりました。

クラスターが人工細胞の端に配置されている間にも、リング状のアクトミオシン波が収縮しているのが観察されます。このとき、アクトミオシン波に押されて、クラスターが人工細胞の中心側に少し動いていることがわかります。一方、アクトミオシン・ブリッジに引っ張られて、人工細胞の壁面側に向かって移動することも観察されます (動画で見てみよう。Sakamoto et al. (2020) の論文ページ 下方の Supplementary information の項目の Supplementary Movie 12 をクリック)。これらの観察を合わせると、クラスターが人工細胞の中心に配置されるか端に配置されるかは、アクトミオシン波の影響とアクトミオシン・ブリッジの影響のどちらが大きいかによって決まると考えられます (図12)。競合する二つの効果において、より効果的にはたらく方の影響が現れるという意味で、坂本さんらはこの仕組みを綱引きモデルと名付けました。
![クリックやタップで拡大 <dfn class="fig">図12</dfn>:<span class="qrinews-figure-title">クラスターが移動する様子</span> 左から右にかけて時間が進み、白の点線は、最初のスナップショットのクラスターの位置を表す。[左] 人工細胞の直径が小さく、アクトミオシン・ブリッジの影響が大きいときには、クラスターは人工細胞の端へ移動する。[右] 人工細胞の直径が大きく、アクトミオシン波の影響が大きいときには、クラスターは人工細胞の中心へ移動する。<a href="#app1" class="link-to-lower-part"><cite class="article"><span class="i">Sakamoto et al</span>. (2020)</cite></a> の図を改変。](images/200930/fig12-b03b88e4.png)

アクトミオシン波とアクトミオシン・ブリッジのどちらの影響が大きく現れるかを判断するには、それぞれの現象が起こる典型的な時間を比較することが重要になります。例えば、アクトミオシン・ブリッジが形成されるには長い時間がかかり、その間にアクトミオシン波が何度も繰り返し発生するとしましょう[7]。このとき、アクトミオシン波の方がより多く作用するため、クラスターは壁面に引き寄せられることなく、中心に配置されるでしょう。逆に、アクトミオシン波が発生する一周期の間に、アクトミオシン・ブリッジが形成されて収縮力が発生すれば[8]、クラスターは人工細胞の端に引き寄せられることになります。これらの状況がいずれも等確率で実現するようなときが、クラスターが人工細胞の中心に配置されるか端に配置されるかの境界(転移点)に相当します。この転移点となる人工細胞の直径を計算してみると[9]、図9の実験結果と一致し、綱引きモデルでクラスターの配置対称性の転移をうまく説明できることがわかります(図13)。

 できるだけシンプルな理解を目指して議論を深めていくことで、少しずつモデルが出来上がり、そして実験結果とも定量的に一致することもわかってきました。とにかくいろいろな可能性を議論して実験的な検証を進めていくことが、良い研究をするために最も重要なことだと思います。
できるだけシンプルな理解を目指して議論を深めていくことで、少しずつモデルが出来上がり、そして実験結果とも定量的に一致することもわかってきました。とにかくいろいろな可能性を議論して実験的な検証を進めていくことが、良い研究をするために最も重要なことだと思います。この研究によって、細胞サイズが細胞の「対称性」と「非対称性」を決めている要因の一つであることがわかりました。人工細胞は自然界に存在している生きた細胞とは完全に同じものではありませんが、アクトミオシンが小さな領域に閉じ込められているという特徴は動物の細胞に共通した性質です。坂本さんが提案するアクトミオシン波とアクトミオシン・ブリッジの綱引きモデルは、細胞のように小さな空間で、いかにして力という物理的要因で対称性を制御できるかという基礎的な課題に新たなメカニズムを提唱するものです。そして、実際の細胞でも配置対称性を制御する仕組みとして存在するものと考えられ、今後は細胞内での解析をすすめる重要な手がかりを与えています。
その他、クラスターの配置の非対称性に起因して、人工細胞が自発的に運動する様子も観察されています。この現象は、実際の生きた細胞の運動とも関係しているはずです。人工細胞を用いたボトム・アップ的[10]なアプローチは、今後さらに細胞の理解を助けてくれるでしょう。
 私は学部時代には固体物理学の理論研究室で卒論を書きました。なので、生物系のアクトミオシンを用いた人工細胞の実験は全く未知のモノであり、研究を進める傍ら、生物学の教科書や論文から知識を積み上げました。人工細胞の研究は比較的新しい分野なので、どんなバックグラウンドの学生でもアイデア次第で面白い研究ができると思います。
私は学部時代には固体物理学の理論研究室で卒論を書きました。なので、生物系のアクトミオシンを用いた人工細胞の実験は全く未知のモノであり、研究を進める傍ら、生物学の教科書や論文から知識を積み上げました。人工細胞の研究は比較的新しい分野なので、どんなバックグラウンドの学生でもアイデア次第で面白い研究ができると思います。 研究では、アクトミオシンの実験家や理論家と多くの議論を重ね、実験や理論の結果を慎重に吟味し、少しずつ実験や理論モデルのアイデアを詰めていきました。多くの人の協力があったからこそ形にできた研究だと思います。
研究では、アクトミオシンの実験家や理論家と多くの議論を重ね、実験や理論の結果を慎重に吟味し、少しずつ実験や理論モデルのアイデアを詰めていきました。多くの人の協力があったからこそ形にできた研究だと思います。
Note:
より詳しく知りたい方は・・・