

大学院理学研究院 物理学部門の植松 祐輝 助教が、「第 5 回 福井謙一奨励賞」を受賞しました (トピックス 2021年1月13日)。今回は、植松助教の研究をご紹介します。

水は、私たちの身の回りのいたるところにありふれています。そのため、生命活動や自然界の物質循環は、様々な物質を溶かしたり状態変化したりする水の物理化学的な性質を有効に活用しています。私たちも、自然界にならって水の様々な性質を利用し、生活を豊かにしてきました。そんな生活に根付き、毎日利用している水ですが、その物理化学的性質は未だ完全に理解されたとは言い切れません。例えば、疎水性界面と呼ばれる、水と空気などが接した境界面では、ジョーンズ・レイ効果と呼ばれる表面張力に関する現象が知られており、そのメカニズムについては未解決のままとなっていました。そこで、物理学部門 複雑物性基礎研究室の植松 助教らは、水に溶け込んだ微量な不純物が疎水性界面に吸着することを考慮することにより、ジョーンズ・レイ効果のみならず、その他の疎水性界面の特性も統一的に説明できることを示しました。この研究成果が認められ、植松助教は福井謙一奨励賞を受賞しました。水の物理化学研究の今後の展開について、社会との繋がりも交えて、植松助教にお話ししていただきます。
異なる 2 つの物質の境目である界面 (表面) は、界面から離れたより内側の部分 (バルクという) に比べ、占める原子や分子の数が少ないため、物質の性質を考える上ではそれほど重要でないと思われるかもしれません。しかし、物質やエネルギーのやりとりは表面を介して行われるため、化学反応などを伴う現象では非常に重要な役割を果たす場合があります。私たちの身の回りにも、フライパンの上を転がる油滴や炭酸飲料・洗剤の泡など、物質の境目が重要なはたらきをする現象を様々なところで見つけることができます。このような物質の表面に着目した分野は、界面科学と呼ばれ、活発な研究が進められています。ただし、ノーベル物理学賞を受賞した物理学者パウリが「固体は神がつくりたもうたが、表面は悪魔がつくった」という言葉を残したように、物質の表面を物理の対象として理論的に扱うのは、より内側の部分 (バルク) の物理に比べると難しくなります。
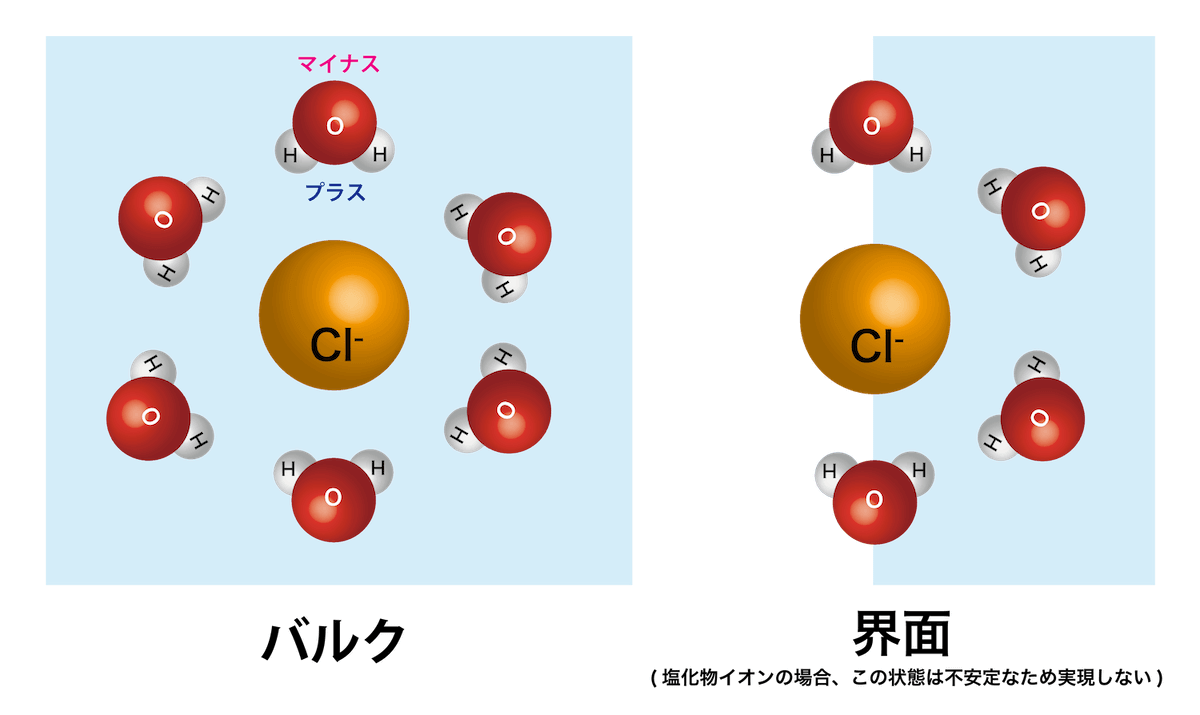
水の界面とバルクでは、何が性質の大きな違いをもたらすのでしょうか?ここでは、電解質が水に溶けるという現象に着目して、その違いについて考えてみましょう。電解質の例として、例えば食塩 (NaCl) を考えます。食塩を水に溶かすと、2 種類のイオン (Na+とCl-) に分かれますが、このとき周囲のたくさんの水分子がそのイオンを包囲します (図1 左)。この状態は水和[1]といい、このようになると食塩は水に溶けて透明になります。水分子 (H2O) は、水素側が少しだけプラスの電荷、酸素側が少しだけマイナスの電荷を帯びている[2]ので、塩化物イオン Cl- の周囲の水分子は、水素側を塩化物イオンに向けた配置となり、一方で、ナトリウムイオン Na+ の周囲の水分子は、酸素側をナトリウムイオンに向けた配置をします。これらのイオンの電荷と周囲の水分子の電気的な偏り (分極) が引き合って安定化することで、食塩は水に溶けることができるのです。ところが界面[3]では、周囲の水は片側にしか存在しておらず、周囲を囲む水分子の数も減ってしまいます (図1 右)。塩化物イオンは水和することで安定化するイオンであるため、半分しか水和されない界面ではエネルギー的に不安定になり、バルクへ逃げてしまいます。

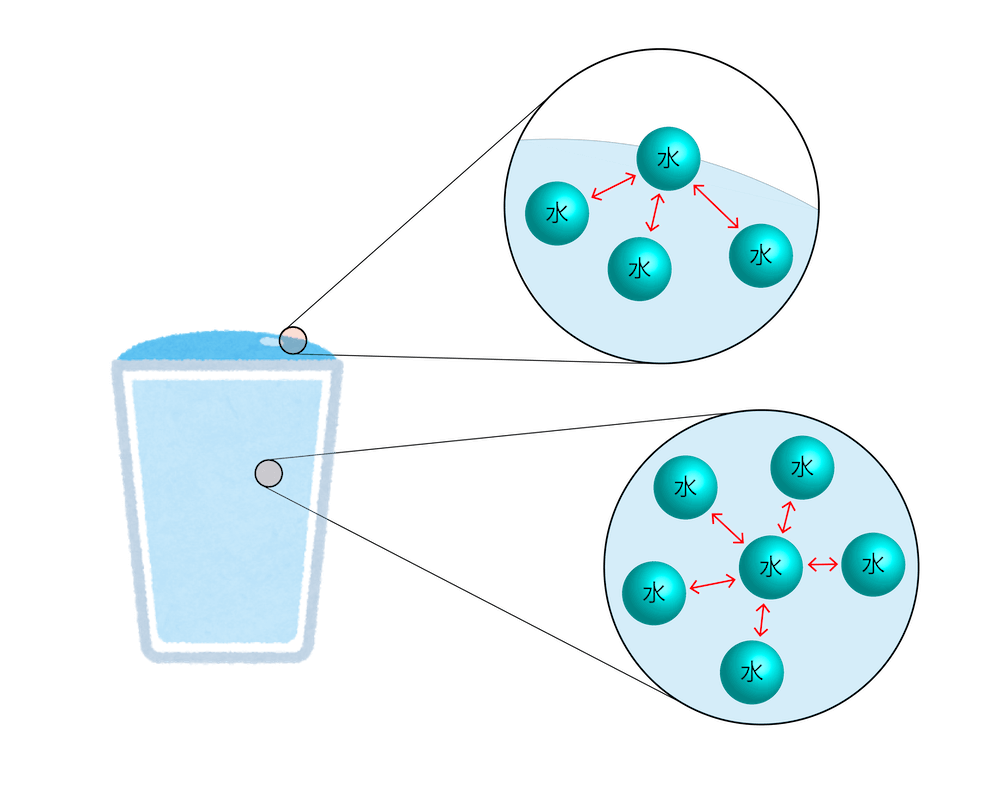
コップに水をなみなみと注ぐと、表面張力によって水面がふくらむことは有名でしょう。この現象も、先ほどお話しした界面とバルクの違いから理解することができます。水分子は電気的な偏りを持っているため、イオンが存在せずとも、水どうしで引き合っています。ちょうど界面に位置する水分子は、他の水分子が片側にしか存在しないために、水側に引っ張られることになります (図2)。その結果、コップから水がこぼれることなく水面がふくらんだ状態が維持できます[4]。
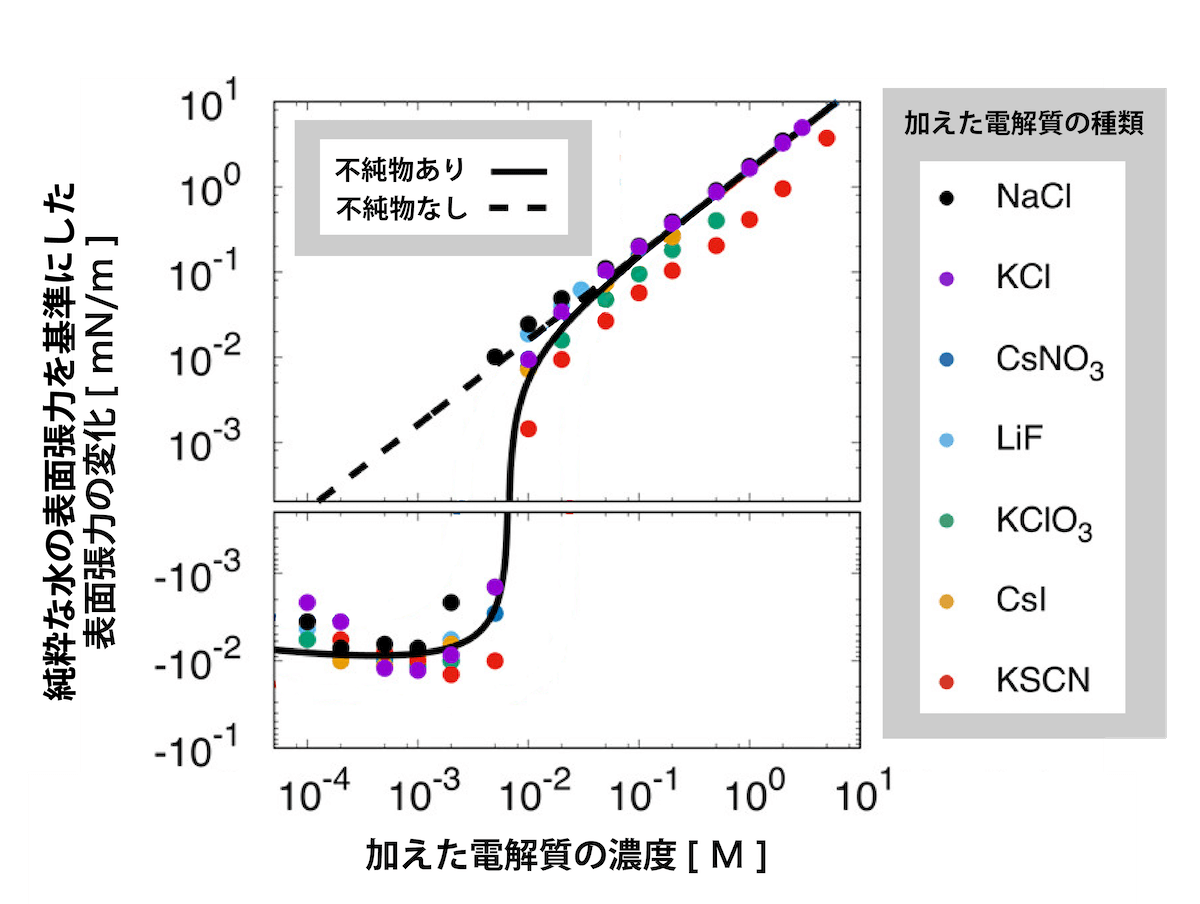
先ほど、物質を水に溶かした場合に生じるイオンの中には、バルクに存在したがる (界面から反発する) ものがあることを説明しました。このことから、水に溶けているイオンの種類や量は、表面張力に影響を及ぼすことが予想されます。具体的には、界面に対して反発するタイプのイオンの濃度が増えると、(溶液が界面をつくることをさらに嫌がるようになり) 表面張力は増加することが知られています[5] (図3)。しかし、この電解質濃度に対する表面張力の変化の様子は、電解質濃度が低い場合には単調ではないことが、1935 年にジョーンズとレイによって発見されました。詳しく言うと、純粋な水から電解質の濃度を徐々に増やしていくと、最初は逆に表面張力が減少し、ある電解質濃度で表面張力が最小になります (図3)。この現象は、ジョーンズ・レイ効果と呼ばれ、身近な問題であるにもかかわらず、原因は未解決で、今もなお議論されています。

ジョーンズ・レイ効果のメカニズムを探るために、植松助教は以下のような理論モデルを提案しました。溶液の物理化学の研究では、溶液中のイオンがつくる電気的な性質を計算できるポアソン・ボルツマン方程式という式がよく用いられます。しかし、この方程式だけでは、イオンが界面に吸着するような効果を含んでいません。ジョーンズ・レイ効果などの溶液表面の現象を調べる上で、十分な結果を得るためには、イオンが界面に反発したり吸着したりする影響を考慮する必要があると考えられます。そこで植松助教は、このイオン反発・吸着の効果を含んだ計算手法を開発しました。
空気中の二酸化炭素は、水に容易に溶け込むことが知られています[6]。実験室で表面張力測定を行う場合にも例に漏れず溶け込んでしまうでしょう。植松助教はまず最初に、二酸化炭素が水に溶けて生じた炭酸水素イオン (HCO3-) の存在を考慮すれば、ジョーンズ・レイ効果を説明できるのではないかと考えました。その計算結果は、図3 の黒の破線で示されています[7]。結果、二酸化炭素の影響を加えるだけでは、ジョーンズ・レイ効果を再現することはできませんでした。
次の方策は、界面に吸着するような不純物が水に微量に溶け込んでいると仮定することです。実験に使うような水は不純物を含まない純水なのでは、と思われるかもしれませんが、不純物の量は非常に微量であるということがポイントです。純水は、普通の水を蒸留したりフィルターに通したりして製造されるため、不純物を完全に取り除くのはほとんど不可能です。水の純度は主に、水の電気の通しやすさで測定されますが、それには測定の限界があり、ある量より低濃度では不純物の存在を検出することができません。植松助教は、数 nM (ナノモーラー、nM = 10-9 mol/L) という検出限界以下の微量な不純物の濃度を仮定し、推定される表面張力の計算を行いました。その結果は、図3 の実線で表されており、実験データをうまく再現しているように見えます。
溶液中の微量な不純物によってジョーンズ・レイ効果が生じているという理論の説得力を高めるために、植松助教は疎水性界面がもつ電気の特性を再現できているかどうかについても調べました。その結果、こちらの測定データも同じ考え方でうまく説明できることがわかりました[8]。
 普段は実験も並行して進めています。理論研究を進めるために必要な実験データがない場合もありますし、理論でやったことは全部実験で確かめたいと思っています。
普段は実験も並行して進めています。理論研究を進めるために必要な実験データがない場合もありますし、理論でやったことは全部実験で確かめたいと思っています。 研究は、不思議に思っていることを自分の力で解決できることが楽しいです。
研究は、不思議に思っていることを自分の力で解決できることが楽しいです。今回の研究により、溶液に含まれる非常に微量な不純物が、表面張力などの性質を大きく変化させることがわかりました。これを逆手に取ると、表面張力を測定することによって、水の純度 (水に含まれる不純物の量) をこれまで検出できなかったレベルで高精度に計測することができるようになると期待されます。不純物をほとんど含まない純水は、研究室で実験に用いられるだけでなく、半導体の洗浄水や発電所で使われる水など工業的な用途も様々です。わずかな不純物の混入でも品質や機能が低下してしまうため、高精度な不純物の検出は、今後の技術革新に必要になってくると予想されます。
 今回の受賞対象の研究は、九大物理に着任する前に取り組んでいた研究です。現在は、水の理論研究を更に深化させるとともに、これらの理論の検証や、水に関する問題を解決するための基礎的な実験研究をすべく、奮闘しています。
今回の受賞対象の研究は、九大物理に着任する前に取り組んでいた研究です。現在は、水の理論研究を更に深化させるとともに、これらの理論の検証や、水に関する問題を解決するための基礎的な実験研究をすべく、奮闘しています。植松助教は、これまでの水の物理化学研究の経験を生かして今後解決していきたい課題と展望についてもお話ししてくださいました。例えば、電解質溶液の界面現象の知見から、ヨウ素は界面に吸着しやすい物質であることが分かっています。海の水は、波しぶきから蒸発する分が多いのですが、そのときにしぶきに吸着した海水中のヨウ素などの成分が粒子[9]として風にのって陸上などに運ばれます。このような元素の循環によって、私たちをとりまく自然界は成り立っています。植松助教は、この環境科学の分野も今後の研究対象として視野に入れているそうです。
そのようにして海水が蒸発すると、それらはやがて雲や河川を流れる水になります。海水には様々な電解質が含まれていますが、河川水や雨水では電解質の量はかなり少なくなります。その電解質の分離を担ったのは、蒸発の際の太陽の膨大なエネルギーです。しかし、現状は汽水域で真水と海水が混ざってしまうだけで、そのエネルギーを有効活用できていません。もしこれを発電などに利用するならば、効率など様々な課題があるかもしれませんが、上手くいけば私たちの生活はより豊かなものになるかもしれません。最後に水の物理化学という観点から、沈殿と濾過などの水から不純物を取り除く浄水技術にも興味を持っているそうです。水の性質をうまく使って、現在用いられている方法よりも省エネルギー・低コストで浄水が行える革新的な方法はないか、可能性を模索しているそうです。
 最近は、環境科学にも非常に興味があります。一つの分野にとらわれずに分野横断的にいろいろ勉強してみると、その分野にしかないモノの見方・考え方を知ることができてとても勉強になります。
最近は、環境科学にも非常に興味があります。一つの分野にとらわれずに分野横断的にいろいろ勉強してみると、その分野にしかないモノの見方・考え方を知ることができてとても勉強になります。 この記事などを見て興味を持ってくれた高校生・大学生と一緒に研究できることを望んでいます。知識だけではなく、具体的に問題を解決するにはどのように取り組んだらいいかというアイデアが出せるかどうかが重要だと思います。
この記事などを見て興味を持ってくれた高校生・大学生と一緒に研究できることを望んでいます。知識だけではなく、具体的に問題を解決するにはどのように取り組んだらいいかというアイデアが出せるかどうかが重要だと思います。  応募に際し、福井謙一先生の恩師である喜多源逸先生を扱った著作「化学者たちの京都学派」 (古川安) を読みました。溶剤、繊維、燃料などといった化学製品の生産技術開発にとって、彼らの量子力学に基づいた純粋理論研究が寄与したとすれば、サイエンスの意義が我々の実生活上で目に見える形に体現されるという、貴重な研究であると感じました。
応募に際し、福井謙一先生の恩師である喜多源逸先生を扱った著作「化学者たちの京都学派」 (古川安) を読みました。溶剤、繊維、燃料などといった化学製品の生産技術開発にとって、彼らの量子力学に基づいた純粋理論研究が寄与したとすれば、サイエンスの意義が我々の実生活上で目に見える形に体現されるという、貴重な研究であると感じました。 私自身は、水の基礎化学、理論化学の研究をしています。水は地球と生命にとって重要な物質であるがゆえに、水処理、治水、気象といった分野の実用上の多くの問題と関連していると考えています。このような問題を基礎研究で解決することは、気の遠くなるような夢ではありますが、ある意味、科学の本来の姿を追うことであると考えています。
私自身は、水の基礎化学、理論化学の研究をしています。水は地球と生命にとって重要な物質であるがゆえに、水処理、治水、気象といった分野の実用上の多くの問題と関連していると考えています。このような問題を基礎研究で解決することは、気の遠くなるような夢ではありますが、ある意味、科学の本来の姿を追うことであると考えています。
Note:
より詳しく知りたい方は・・・