

スマートフォンやテレビのディスプレイでよく耳にする有機 EL (エレクトロ・ルミネッセンス) パネルには、有機物に電圧をかけると発光するという仕組みが利用されています。このように、発光する物質は工学的な応用も多く、より高効率かつ色純度の高いものを求めて、様々な材料が開発されています。しかし、そのような発光材料の中には、なぜ高効率な発光を示すのか詳しく分かっていないものが多数存在します。その 1 つが、希土類金属[1]の錯体[2]です。化学専攻 分光分析化学研究室の宮崎さんらは、特に三価ユウロピウム (Eu3+)[3]の錯体に注目しました。この錯体の発光の様子を、非常に短い時間間隔で追跡し分析を行ったところ、これまで知られていなかった新しいエネルギー移動のメカニズムがあることが示唆されました。発光材料の基礎的な性質を理解することは、新たな高効率発光材料を開発するヒントとなるため、宮崎さんらの研究は非常に重要です。この研究成果は、The Journal of physical Chemistry A に掲載されています。
中学や高校の化学で勉強したように、原子は中心の原子核とそのまわりの電子から構成されています。その電子は、原子軌道 (電子軌道) と呼ばれる原子核のまわりの、電子が存在しやすい領域を飛び回っています[4]。その原子が複数集まると分子ができますが、分子のまわりにも同様に電子が存在しやすい領域を考えることができて、それは分子軌道といいます (図1)。1 つの分子に対して、分子軌道は複数の種類が存在し、普段はその中で一番エネルギーが低く安定な配置のものが選ばれます。これを基底状態といいます。何らかの理由で分子にエネルギーが加えられると、基底状態以外の分子軌道をとることもできるようになり、この状態を励起状態といいます。
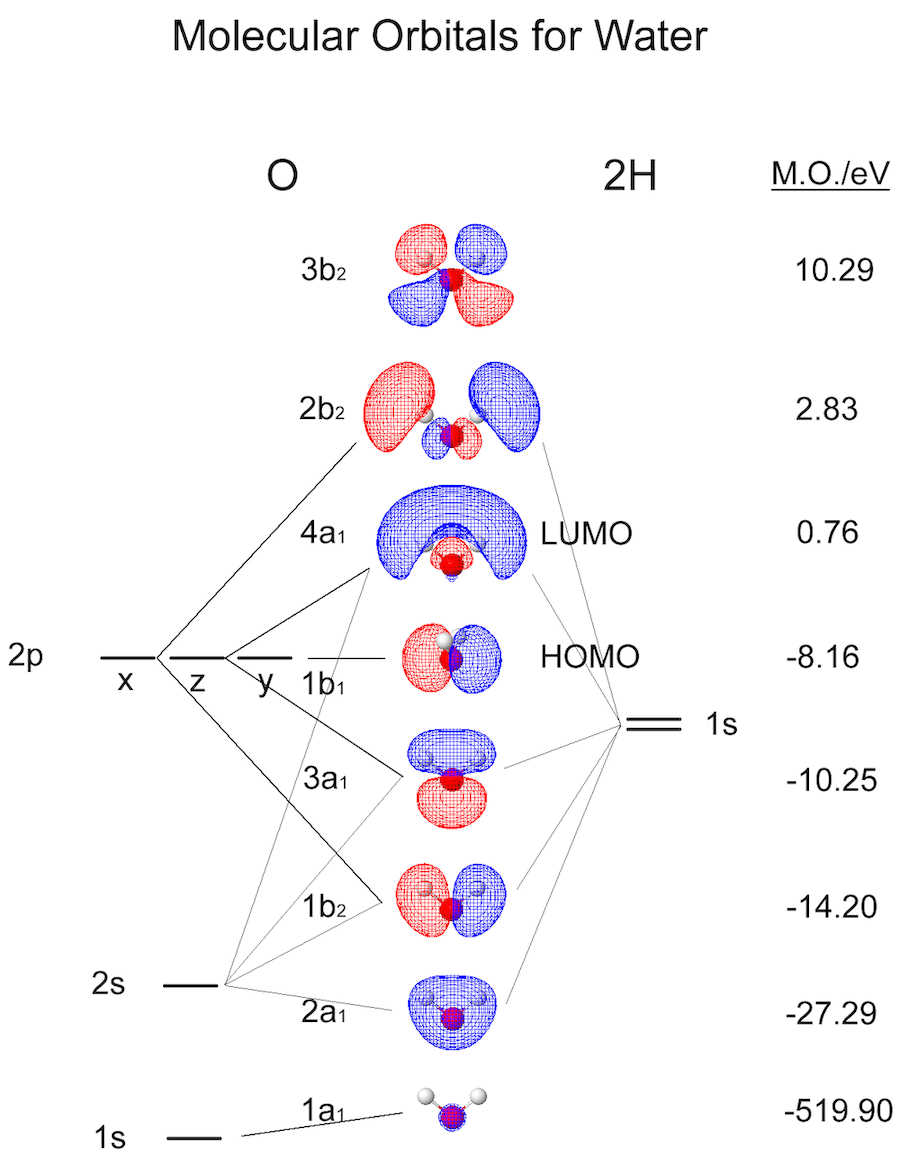

もし分子に光を照射した場合、どのようになるでしょうか?光は電磁波の一種で、その正体は振動する電場と磁場です。原子核はプラスの電荷、分子のまわりを飛び回る電子はマイナスの電荷を持っているので、その振動する電場によって分子は揺さぶられてしまいます。このとき、分子はエネルギーを受け取り、励起状態に遷移することができます[5]。しかし、分子たちは安定な基底状態になることを好んでいます。励起状態から基底状態へ戻るために、いくつかの段階[6]を経て受けとったエネルギーを放出しますが、その際に光として放出する場合があります。これが、物質が発光する仕組みです。ただし、全ての状態間の遷移で光が放出されるわけではないということに注意しましょう。多くの過程では、光ではなく熱としてエネルギーを放出します。加えて、どの状態間の遷移かによって、放出される光の波長[7]やエネルギー放出の速さ (どのくらいのスピードで状態間の遷移が完了するか) も異なります。これを逆手に取ると、分子から発せられる光を詳細に調べることで、分子がどのような励起状態を経て、基底状態に落ち着いたのかを推測することができます。
三価ユウロピウムイオン (Eu3+) は、波長 615 nm[8]の鋭い発光スペクトル[9]をもつ、混じり気のない綺麗な赤色の発光をすることが知られています (図2)。この色純度の高さは、ただ有機物を発光させるだけでは達成できないため、工学的な応用が期待されます。しかし一方で、 Eu3+ は光から直接エネルギーを受け取りにくいという性質もあるため、そのままでは発光材料として利用できません。この問題点は、アンテナのように光を受け取る機能のある非金属 (配位子)をユウロピウムイオンに結合させて、錯体にすることで解決できます。この配位子が、光からエネルギーを受け取った後、そのエネルギーの一部をユウロピウムイオンに渡してくれれば、効率よく発光させることができるのです。現在では、より高効率な発光材料を求めて、様々な配位子をもつ錯体が作成されています。しかし、高効率な発光の詳細なメカニズムは未だ理解されていないため、どのような配位子を選べば良いかの指針がなく、試行錯誤しているのが現状です。

 発光性希土類錯体が光っているのは、とてもきれいです!
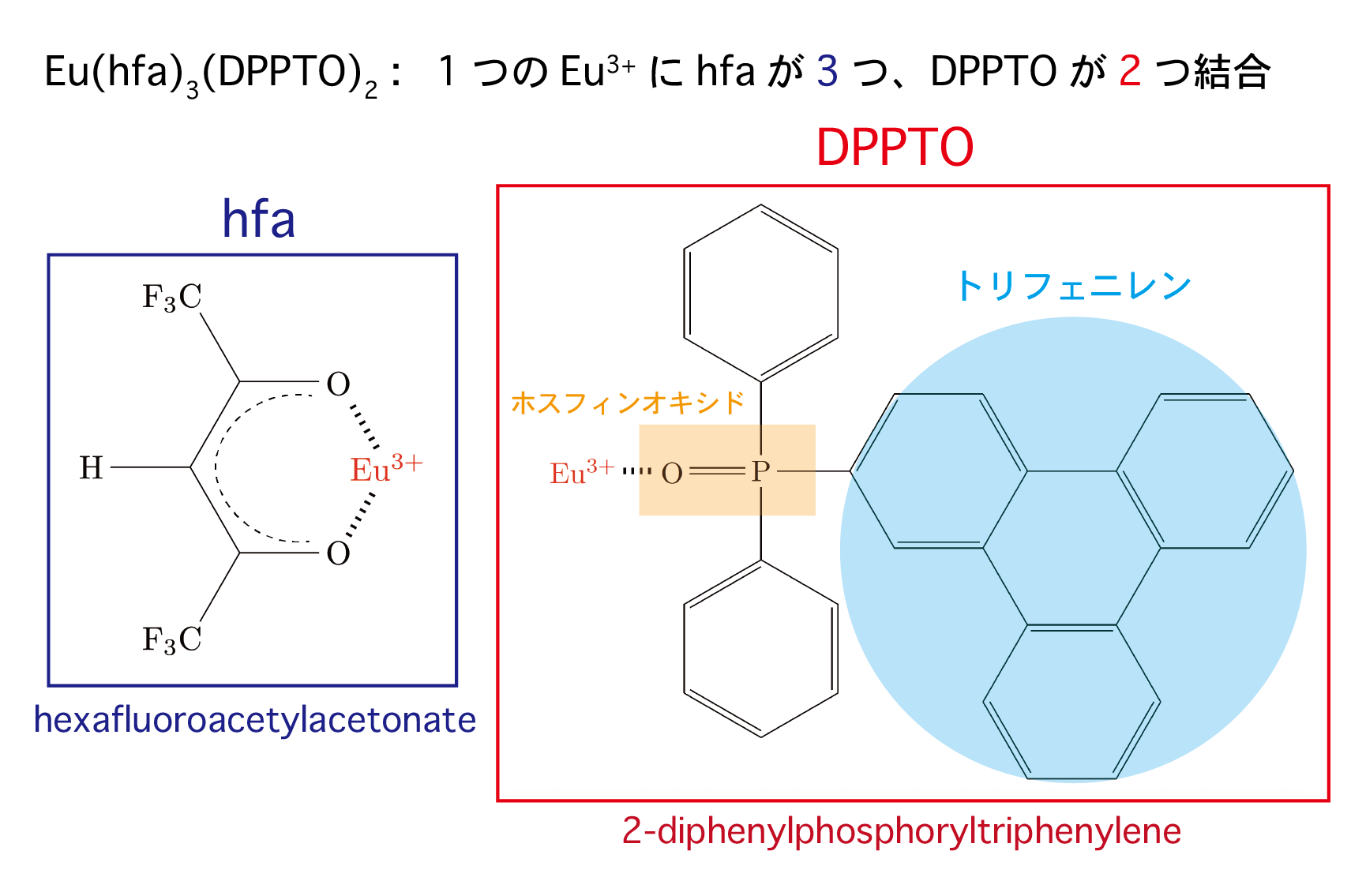
発光性希土類錯体が光っているのは、とてもきれいです!今回、宮崎さんらが研究した発光材料は、Eu(hfa)3(DPPTO)2 というユウロピウム錯体です (図3)。この錯体は、効率の良い発光材料として知られていましたが、なぜ高効率な発光を示すのか詳しく理解されていませんでした。構造式 (図3) は、慣れていない方々には少し複雑に見えるかもしれませんが、注目すべき点は DPPTO と呼ばれる配位子がユウロピウムイオンに 2 つ結合していて、その DPPTO にはトリフェニレン (図3の水色の部分) が含まれていることです。このトリフェニレンがアンテナの役割をし、光を吸収してユウロピウムイオンにエネルギーを渡します。しかし、トリフェニレンとユウロピウムイオンの間は、ホスフィンオキシド (図3の橙色の部分) によって結合されていて、両者は隣接していません。このように距離が空いていると、トリフェニレンとユウロピウムイオンの相互作用は小さくなって、効率よくエネルギーが輸送されないと考えられます。しかし、現実では効率の良い発光が確認されています。これはなぜでしょうか?

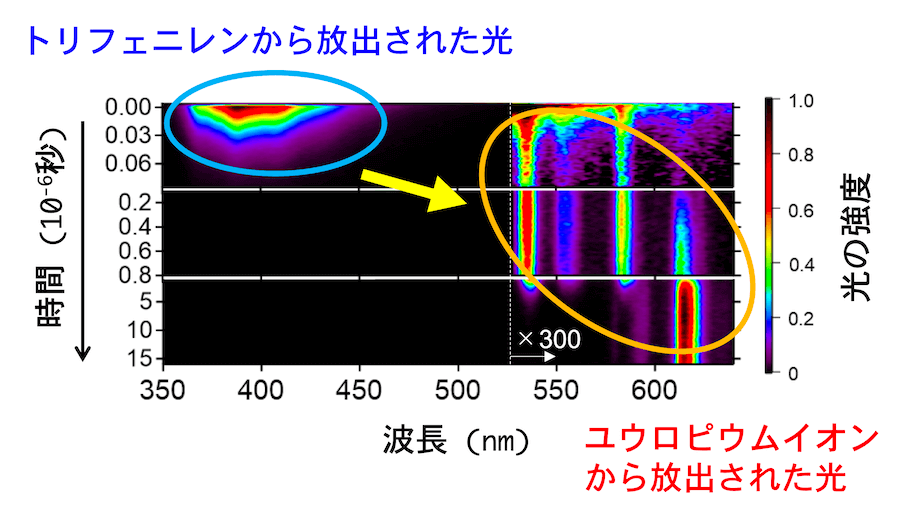
宮崎さんが所属する分光分析化学研究室には、10-12 秒 (ピコ秒) といった非常に短い時間間隔で発光の変化の様子を分析できる装置があり、化学変化のような非常に速い現象を捉えることができます[10]。宮崎さんらは、三価ユウロピウム錯体 Eu(hfa)3(DPPTO)2 を含む溶液に、励起光として波長 267 nm の光を照射し、その後の発光の様子を分析しました。267 nm は、トリフェニレンに最も吸収されやすい波長領域です。この分析の結果は、(図4) に示されています。励起光を照射した直後は、およそ 360 nm から 500 nm の波長にわたって幅広い発光スペクトルが観察され、これはトリフェニレンから放出された光であると考えられます。時間が少し経過すると、トリフェニレンからの発光は弱まり、より波長が長い領域に鋭いスペクトルがいくつか見つかります。これは、トリフェニレンからエネルギーを受け取ったユウロピウムイオンの発光と考えられます。ユウロピウムイオンの発光スペクトルの中にも、発光の継続時間の違いが見られますが、これはユウロピウムイオンが複数の励起状態を経て基底状態に落ち着いていることを反映しています。

 実験で綺麗なスペクトルをとるのが難しくて大変でした。また、ユウロピウム錯体の先行研究が少ないので、どのような結果が出れば正解なのかがわからず苦労しました。
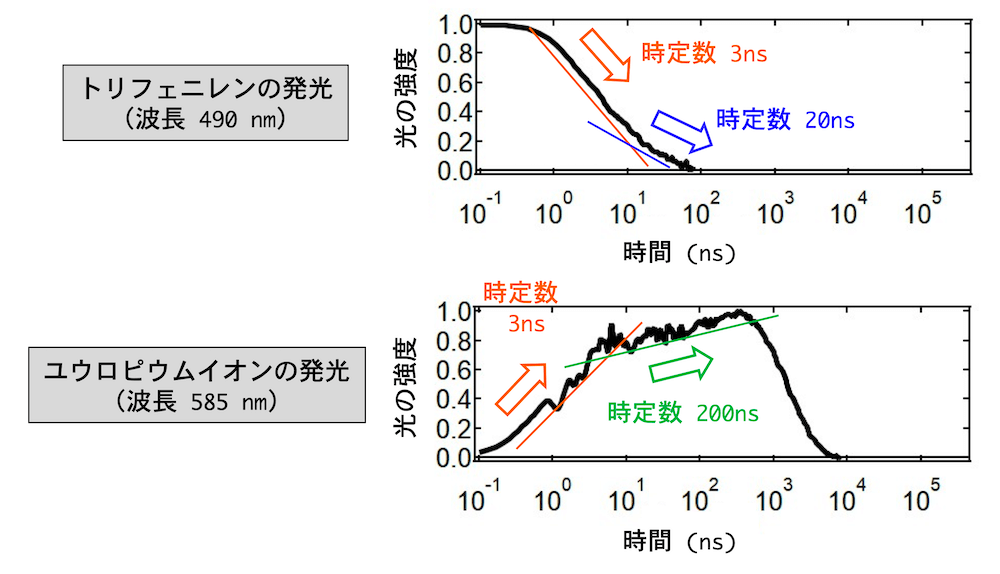
実験で綺麗なスペクトルをとるのが難しくて大変でした。また、ユウロピウム錯体の先行研究が少ないので、どのような結果が出れば正解なのかがわからず苦労しました。得られた発光スペクトルの時間変化の様子をより詳細に調べるために、特定の波長だけに注目したグラフが (図5) です。(図5) の上のグラフは、波長 490 nm の光の強度変化を表していて、グラフの右下がりの様子はトリフェニレンがエネルギーを手放す速さを示しています。この光の強度の減衰速度を評価するために、時定数という時間の次元を持つ量を考えます。この量は、強度が初期値からおよそ 37% に減少、もしくは最大値の 63% まで増加するのにかかる時間です[11]。この時定数を求めると、(図5) の上のグラフには2 種類の時間変化が含まれていることがわかります。一方は時定数 3 ns[12]という速い変化、もう一方は時定数 20 ns という比較的緩やかな変化です。
次に、波長 585 nm の光の強度の時間変化が、(図5) の下のグラフに示されています。この右上がりの様子は、ユウロピウムイオンがエネルギーを受け取る速さを示しており、このグラフにも 2 種類の速さが異なる過程が含まれていることがわかります。一方は、トリフェニレンの発光の場合と同じ時定数 3 ns の変化で、もう一方は時定数 200 ns というゆっくりとした時間変化です。

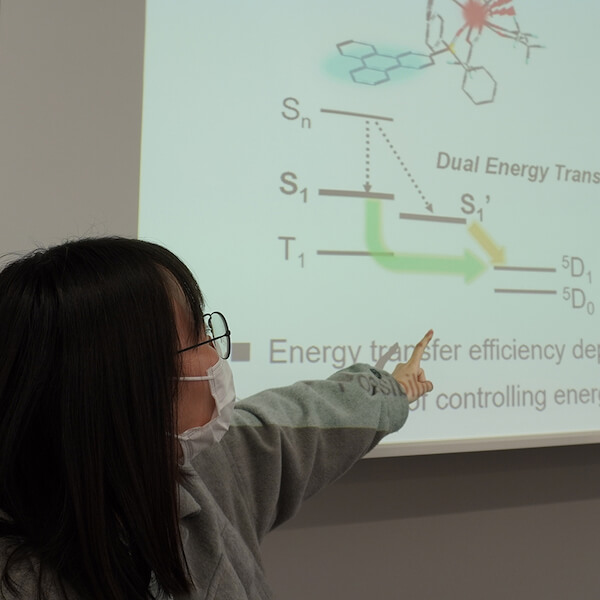
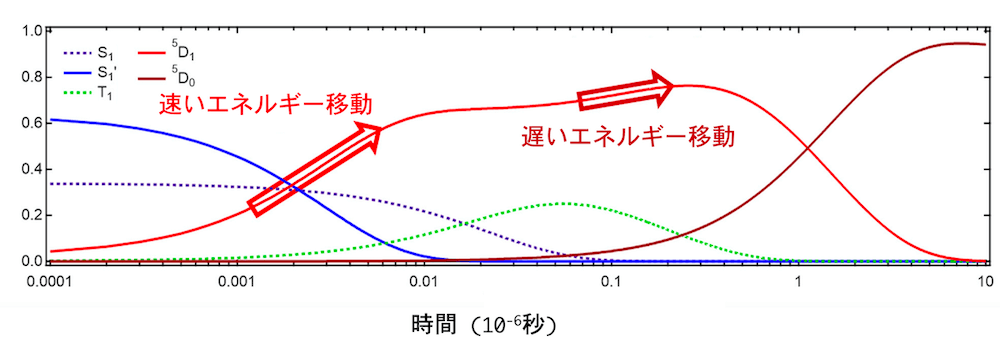
以上のことをまとめると、トリフェニレンからユウロピウムイオンへのエネルギーの移動には、(図6) のような速いエネルギー移動 (図6の緑色の矢印) と遅いエネルギー移動 (図6の水色の矢印) の2 種類の異なる過程があることが推測されます。エネルギー移動の速さに違いがある理由は、経由する励起状態が異なるためだと考えられます。この異なる励起状態は、(図6) にも S1 と S1’ として示されています。特に、速いエネルギー移動機構の原因となっている励起状態 S1’ の存在は、これまでの研究では知られていませんでした。新たに見つかった励起状態 S1’ が確かに存在することは、トリフェニレンの発光スペクトルからも確認されています (図7) 。
![クリックやタップで拡大 <dfn class="fig">図6</dfn>:<span class="qrinews-figure-title">Eu(hfa)<sub>3</sub>(DPPTO)<sub>2</sub>のエネルギー移動を表す<a href="#foot6" title="励起状態にはたくさんの種類が存在し、光を吸収して励起状態から基底状態へ戻る途中で、いくつかの他の励起状態を経由します。その経路を図示したものをヤブロンスキー図といいます。">ヤブロンスキー図<sup>[6]</sup></a></span> 基底状態の Eu(hfa)<sub>3</sub>(DPPTO)<sub>2</sub> に 267 nm の励起光を照射すると、トリフェニレンがエネルギーを受け取り、S<sub>n</sub> という励起状態になる。そこから、励起状態 S<sub>1</sub> と励起状態 S<sub>1</sub>’ のどちらかへ光を放出せずに状態遷移する。この S<sub>1</sub> と S<sub>1</sub>’ から基底状態への遷移によって、トリフェニレンの発光が起こる。一方で、錯体分子によってはユウロピウムイオンへエネルギーを渡すものもある。このとき、S<sub>1</sub> の状態の錯体がエネルギーを渡すのと、S<sub>1</sub>’ の状態の錯体がエネルギーを渡すのでは、エネルギー輸送の速さが異なる。私たちが実験などで扱う試料には、非常に多くの分子が含まれており、様々な経路をたどる分子が混ざった状態が観察されていることに注意。](images/201218/fig6-c7202e73.png)

![クリックやタップで拡大 <dfn class="fig">図7</dfn>:<span class="qrinews-figure-title">異なる励起状態 S<sub>1</sub> と S<sub>1</sub>’ からのトリフェニレンの発光スペクトルの違い</span> [黒の線] 励起光を照射後 0 〜 2 ns の間の発光スペクトル。励起状態 S<sub>1</sub> からと励起状態 S<sub>1</sub>’ からの両方のスペクトルを含んでいる。[青の線] 励起光を照射後 50 〜 80 ns の間の発光スペクトル。励起状態 S<sub>1</sub>’ だった分子はすでに他の状態へ遷移してしまっているため、励起状態 S<sub>1</sub> からのスペクトルのみを含んでいる。[橙色の線] 黒の線から青の線を引いたもの。励起状態 S<sub>1</sub>’ からのスペクトルのみを含んでいると考えられる。励起状態 S<sub>1</sub>’ からの発光スペクトル (橙色の線) は、励起状態 S<sub>1</sub> からの発光スペクトル (青の線) に比べ、波長が長い方にずれているため、別のエネルギー状態であると考えられる。グラフは、<a href="#app1" class="link-to-lower-part"><cite class="article"><span class="i">Miyazaki et al</span>. (2020)</cite></a>と同様のものを宮崎さんより提供。](images/201218/fig7-ef716f5e.png)

 時定数 200 ns というエネルギー移動は、他の一般的な希土類錯体のエネルギー移動に比べると非常に遅いです。これは、トリフェニレンとユウロピウムイオンの間の、ホスフィンオキシドによる結合が原因であると考えています。
時定数 200 ns というエネルギー移動は、他の一般的な希土類錯体のエネルギー移動に比べると非常に遅いです。これは、トリフェニレンとユウロピウムイオンの間の、ホスフィンオキシドによる結合が原因であると考えています。実験で確認された 2 種類のエネルギー移動機構が確かなものかを検証するために、発光強度の変化を計算する数値シミュレーションも行われました。宮崎さんらは、1 種類のエネルギー移動機構しか存在しない場合と 2 種類のエネルギー移動機構がある場合の 2 つの設定を考え、発光強度がどのように変化するかをコンピュータを使って計算しました[13](図8)。その結果、1 種類のエネルギー移動機構しか存在しない場合は、実験結果を上手く再現することができないことが分かりました。得られた実験結果を再現するためには、2 種類のエネルギー移動機構が必要であると考えられます。

 わからないことが、研究を進めるにつれてだんだんとわかってくることが、とても楽しいです。
わからないことが、研究を進めるにつれてだんだんとわかってくることが、とても楽しいです。新たなエネルギー移動のメカニズムが見つかったことで、ユウロピウム錯体の高効率な発光の理解に一歩近づきました。このような基礎的な理解の積み重ねが、画期的な発光材料の開発に繋がると期待されます。
今回の研究では、溶液内のユウロピウム錯体を対象にしていましたが、実際にデバイスに応用される場合は、錯体は固体の中に閉じ込められた状態になっています。実は、ユウロピウム錯体 Eu(hfa)3(DPPTO)2は、異なる分子に少量添加して固体の状態にした方が効率の良い発光を示すことが分かっています。このことは、錯体内だけではなく、まわりの分子とのエネルギーのやりとりが重要であることを示唆しています。今後は、錯体が存在する環境の影響について調べていきたいと考えているそうです。
 今回報告した 2 通りのエネルギー移動過程を見つけることができたのは一度論文を書きおえた後でした。一見違いが見られないデータでも注意深く観察することで、新たな結論が導き出せるという経験をすることができ、研究の奥深さを改めて実感することができました。
今回報告した 2 通りのエネルギー移動過程を見つけることができたのは一度論文を書きおえた後でした。一見違いが見られないデータでも注意深く観察することで、新たな結論が導き出せるという経験をすることができ、研究の奥深さを改めて実感することができました。
Note:
より詳しく知りたい方は・・・