


近年、IoT 家電[1]やウェアラブル端末[2]の電源として、活用の難しい低温の熱エネルギーを利用した熱電変換が期待されています。特にこの低温の熱エネルギーを電気エネルギーに変換する方法として可逆な酸化還元反応を利用する熱化学電池といわれる熱電変換手法が注目されるようになりました。そこで、私たちの研究室 (化学専攻 ナノ機能化学研究室) でこれまで研究してきたカルボン酸の電気化学的な酸化還元反応を応用して、資源量が豊富な酸化チタンと体にも含まれている乳酸やピルビン酸といった生体親和性の高い材料を使った新しい熱化学電池を構築し、その性能の測定をしました。さらに、この熱化学電池の反応では熱力学的な理論とは逆転して反応が起こることを発見し、この逆転に電極上に吸着した水素が重要であることを明らかにしました。この研究成果は、Scientific Reports に掲載されています。
現在、工場などから出される多くの廃熱が未使用のまま放出されており、この廃熱の有効利用として熱電変換が注目されています。この熱電変換は 図1 のように熱エネルギーを電気エネルギーに変換する方法であり、廃熱を電気に変えることができます。しかしながら、特に

 この研究は、最初は九州大学の工学部の君塚研究室に所属されていた山田 鉄兵 先生 (今は東京大学) のグループとの共同研究から始まりました。これは私たちの研究室で研究していた酸化チタンを用いたカルボン酸の電気化学的な酸化還元反応と、山田先生たちが研究していた熱化学電池の知識が合わさって生まれた研究でした。
この研究は、最初は九州大学の工学部の君塚研究室に所属されていた山田 鉄兵 先生 (今は東京大学) のグループとの共同研究から始まりました。これは私たちの研究室で研究していた酸化チタンを用いたカルボン酸の電気化学的な酸化還元反応と、山田先生たちが研究していた熱化学電池の知識が合わさって生まれた研究でした。今回構築した熱化学電池の原理について熱力学的な観点から詳しく説明します。熱化学電池は可逆な酸化還元平衡状態にある酸化体と還元体を用いるものですが、酸化還元平衡は平衡であるため、低温ではエンタルピー駆動[5]の方向に、高温ではエントロピー駆動の方向に平衡が移動します。ここで下のような酸化体 (A) が還元されて還元体 (B) となる反応を考えます。
\(n\) は反応の電子数を表します。このときギブズエネルギー[6]の変化 (\(\Delta G\)) とエンタルピー (\(H\))、エントロピー (\(S\))、温度 (\(T\)) は次のような関係にあります。
ここで \(F\) はファラデー定数[7]、\(V\) は電位、\(S_\mathrm{A}\)、\(S_\mathrm{B}\) は A、B の部分モルエントロピー、\(S_\mathrm{e}\) は熱電変換の性能を示すゼーベック係数を表します。最後の式から分かることは、温度あたりに得られる起電力は、酸化体 A と還元体 B のエントロピーの差に比例するということです。
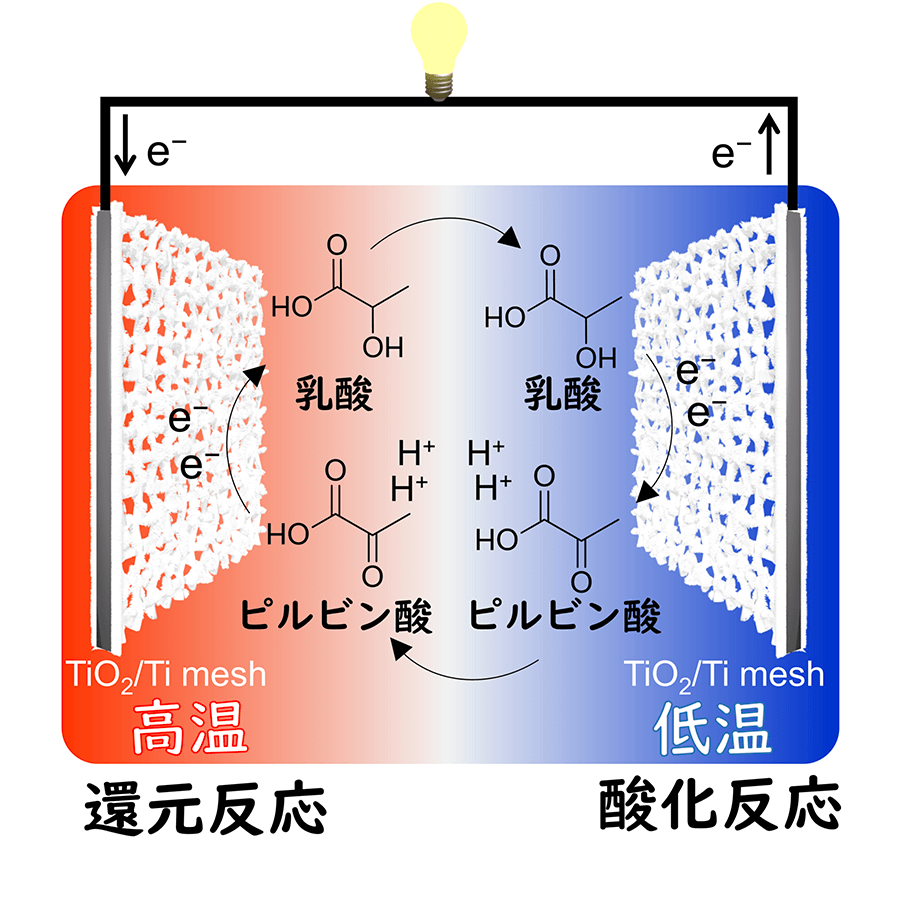
ここで今回構築した熱化学電池について理論的に考えます。今回は酸化体としてピルビン酸、還元体として乳酸を用いた熱化学電池であるため、次のような反応になります。
熱化学電池は、この平衡反応の起こりやすさが温度によって異なることを利用して、反応式中の電子を取り出すことで電気エネルギーを取り出しています。この反応に対して熱力学的なパラメーターを用いて、この熱化学電池のゼーベック係数の理論値を求めると -2.20 mV/K と求まります。
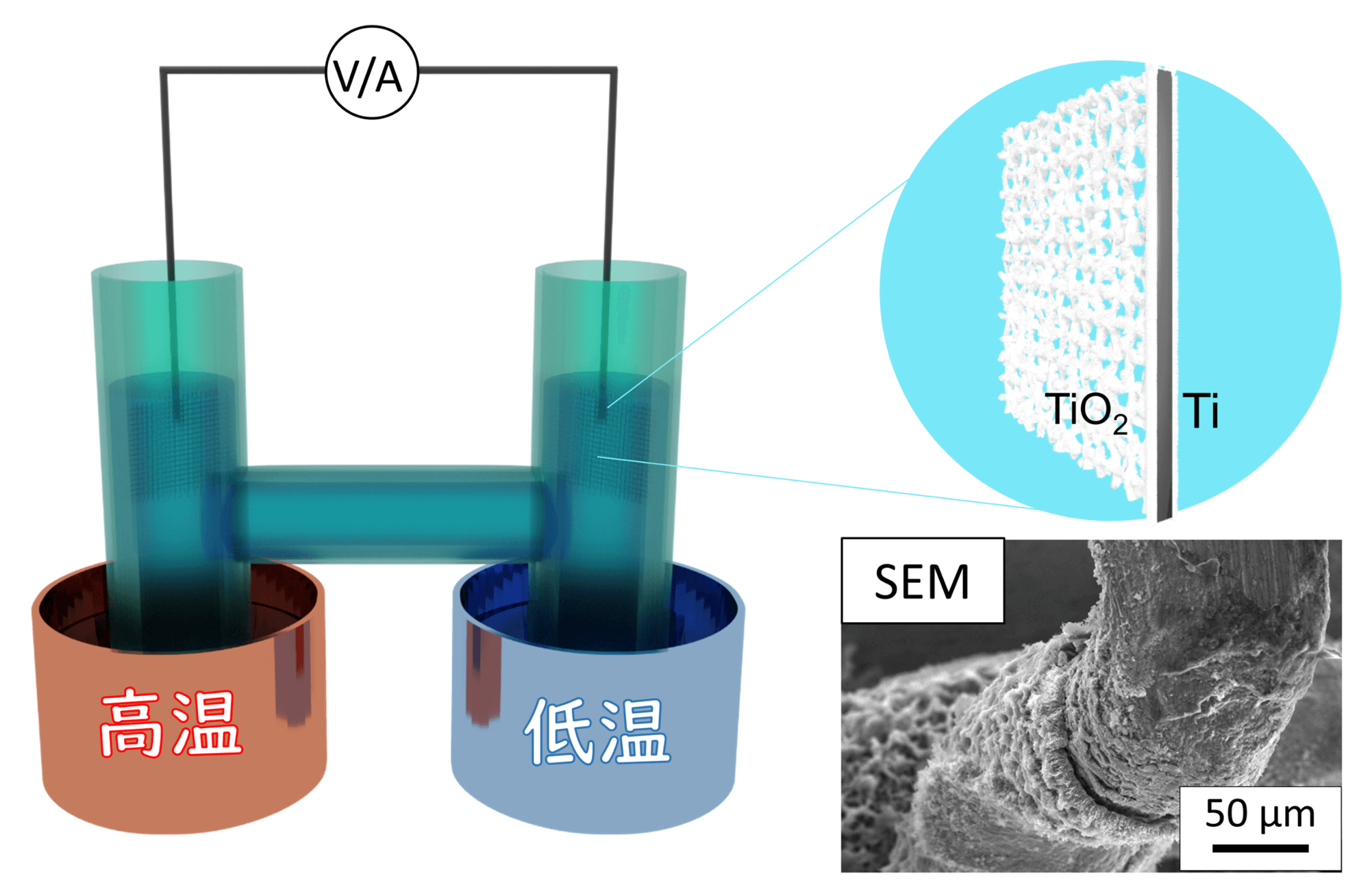
この実験では、図3 のような熱化学電池反応セルを構築しました。まず、H 字型のガラスセルにメッシュ状のチタンの周りに酸化チタンを成長させた電極とピルビン酸、乳酸の入った溶液を入れました。そして H 字型のガラスの片方を水浴で冷やし、片方の水浴を加熱することで電極の両側に温度差を作り、温度差に対して、どれだけの起電力が得られるかを測定しました。また、対照実験として、多くの反応に対して触媒活性が高い白金を用いた場合でも実験を行いました。

 最初は工学部の山田先生たちの実験室を借りて実験していたので、普段の研究室から遠い工学部のウエストゾーンの実験室まで毎週のように通って実験していました。
最初は工学部の山田先生たちの実験室を借りて実験していたので、普段の研究室から遠い工学部のウエストゾーンの実験室まで毎週のように通って実験していました。 得られた実験結果を 図4 に示します。図4 は横軸が温度差 (\(\Delta T\))、縦軸が得られた起電力
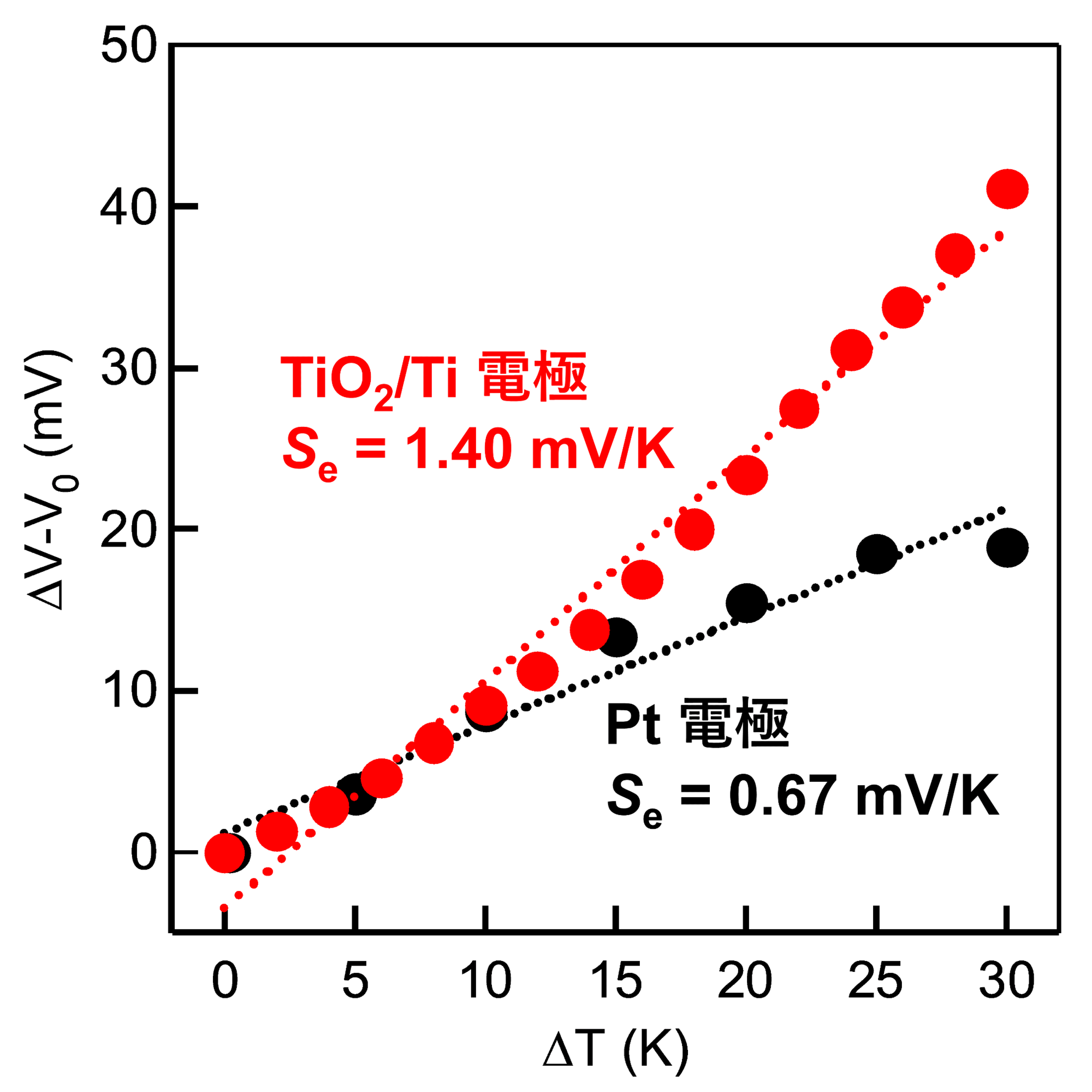

 熱化学電池の熱電変換を発見できたのですが、最初のころはゼーベック係数が逆転している理由がわからず、電極や条件を変えて実験を行っては、ディスカッションしながら研究を進めていきました。
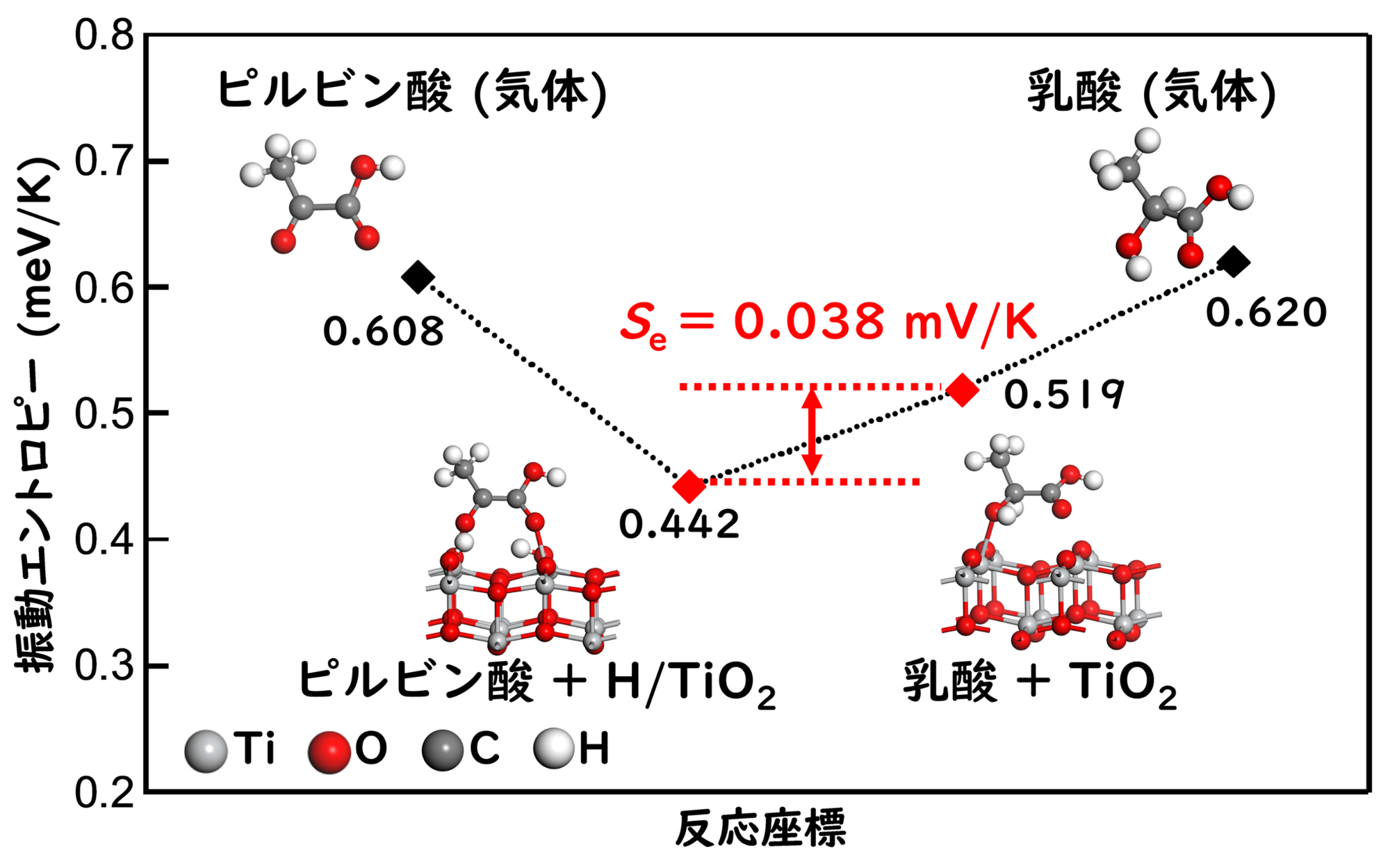
熱化学電池の熱電変換を発見できたのですが、最初のころはゼーベック係数が逆転している理由がわからず、電極や条件を変えて実験を行っては、ディスカッションしながら研究を進めていきました。ゼーベック係数の符号が逆転したという結果を説明するために、計算化学の DFT 計算[8]という手法を用いました。図5 のように DFT 計算によって各分子の振動エントロピーを計算すると、ピルビン酸と乳酸だけの場合の振動エントロピーの差は小さく負のゼーベック係数となることがわかりました。しかしながら、酸化チタン上に水素イオンが吸着している状態で、ピルビン酸と乳酸が吸着する場合の振動エントロピーを計算すると、その振動エントロピーの差は正のゼーベック係数に対応する値が求められました。これによって酸化チタンが反応への水素イオンの供給に重要な役割を果たしていることが明らかになり、熱化学電池において電極上での分子やイオンの吸着が極めて重要であることを初めて発見しました。

 計算化学は広島大学の石元 孝佳 先生にお願いして、共同研究を進めていきました。多くの人が関わって、わからないことが次第に説明できるようになっていったのは、おもしろかったです。
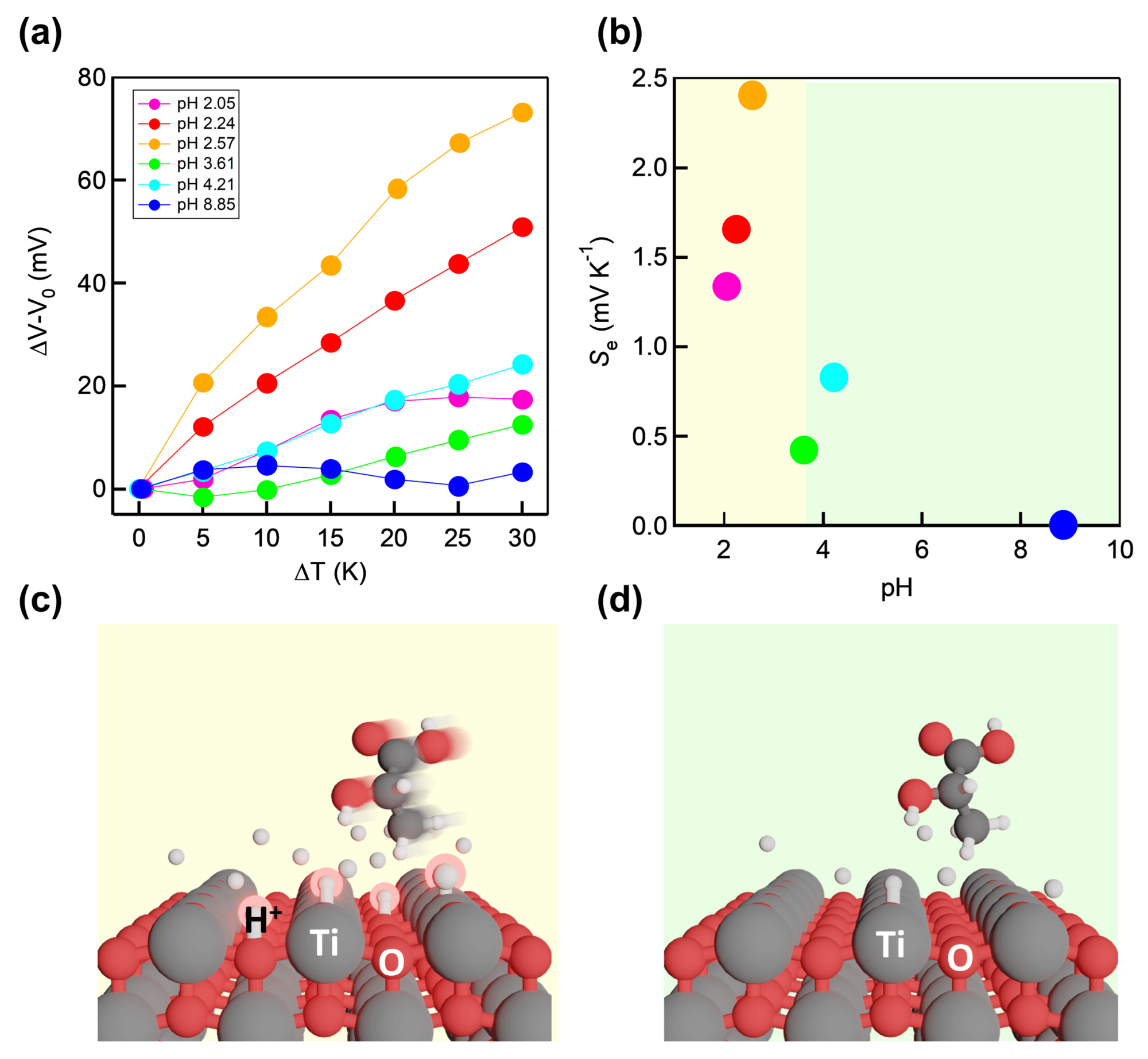
計算化学は広島大学の石元 孝佳 先生にお願いして、共同研究を進めていきました。多くの人が関わって、わからないことが次第に説明できるようになっていったのは、おもしろかったです。さらにこの発見を裏付ける実験として、水溶液の水素イオンの濃度つまり pH を変化させて、同様の実験を行いました。その結果が、図6 (a) です。得られたゼーベック係数は 図6 の (b) のように pH が大きい塩基性の条件ではゼーベック係数が小さい値であるのに対して、pH が小さい酸性の条件ではゼーベック係数が大きな値となるという実験結果が得られました。これは 図6 (c) のように pH が小さく水素イオンが多い状態では、水素イオンの受け渡しが影響した酸化還元反応が起こりやすい状態であるためゼーベック係数が大きくなり、一方で 図6 (d) のように pH が大きく水素イオンが少ない状態では、反応があまり進行しなかったためゼーベック係数が小さくなるという計算化学の説明を裏付ける実験結果が得られました。

私たちは生体親和性の高い酸化チタンやピルビン酸、乳酸を用いた熱電変換の一種である熱化学電池を初めて構築し、熱電変換とその性能を測定しました。さらに、この熱化学電池の反応では熱力学的な理論とは逆転して反応が起こることを発見し、この逆転が電極上での水素イオンの受け渡しと関わっていることを明らかにしました。この発見は熱化学電池において電極上での吸着が重要であるという初めての発見であり、この知見が、今後の性能の高い熱化学電池の発見や熱化学電池の実用化に繋がることを期待しています。
 初めて挑戦する熱化学電池だったため、当初はゼーベック係数の再現性がとれない場合があり、数十回の実験を繰り返しました。そのなかで、前処理の必要条件が明らかになり、苦労した結果、再現性がとれた結果が得られるようになりました。
初めて挑戦する熱化学電池だったため、当初はゼーベック係数の再現性がとれない場合があり、数十回の実験を繰り返しました。そのなかで、前処理の必要条件が明らかになり、苦労した結果、再現性がとれた結果が得られるようになりました。 この研究を行っている途中で山田先生が東京大学に栄転されたので山田先生の実験室で実験を続けられなくなり、途中で新しく自分たちの実験室で器具や測定機器などを準備して、実験を行いました。全く違う実験室でもしっかり再現性がとれた時は、胸をなでおろしました。
この研究を行っている途中で山田先生が東京大学に栄転されたので山田先生の実験室で実験を続けられなくなり、途中で新しく自分たちの実験室で器具や測定機器などを準備して、実験を行いました。全く違う実験室でもしっかり再現性がとれた時は、胸をなでおろしました。 実験を始めた時期は、実験室で実験を行ったり、他の先生や学生たちと部屋でディスカッションできていたのですが、論文が査読されている段階で、新型コロナウイルスの影響があり Zoom を使ったオンラインでのディスカッションに変わったり、実験室に行けない日々があったりして苦労しました。
実験を始めた時期は、実験室で実験を行ったり、他の先生や学生たちと部屋でディスカッションできていたのですが、論文が査読されている段階で、新型コロナウイルスの影響があり Zoom を使ったオンラインでのディスカッションに変わったり、実験室に行けない日々があったりして苦労しました。
Note:
より詳しく知りたい方は・・・