


悪性化したがん細胞は非常に高い運動能力を持ち、血管内へと潜り込み、体内の別の組織へと転移します。この時、がん細胞は前方にブレブと呼ばれる大型の突起を活発に形成し、これを足として使うことで、自らの形態を大きく変形させながら狭い隙間を潜り抜けるように移動します。しかし、細胞がどのようにして急激なブレブの拡大を可能にし、自らの形態をダイナミックに変形させているのかは全く明らかになっていませんでした。
大阪大学 微生物病研究所の青木 佳南 (研究当時 本学大学院理学研究院 生物科学部門 特任助教) と九州大学 大学院理学研究院 生物科学部門の池ノ内 順一 教授らは、拡大中のがん細胞のブレブ内では、細胞質の流動性が大きく上昇し、柔らかい細胞質領域が形成されていることを見出しました。さらに、拡大中のブレブ内にはカルシウムイオンが大量に流入しており、それにより細胞質の性質の変化が起こることが分かりました。この研究により、細胞は部分的に細胞質の柔らかさを変化させることで、細胞運動時の柔軟な変形を可能にしていることが初めて明らかになりました。この研究成果は、Nature Communications に掲載されています。
私たちの体は様々な種類の細胞により構成されています。その中には、高い運動能力を持ち、組織中を動き回る細胞も存在します。例えば免疫細胞は、組織内を活発に運動し、血管内に潜り込んで血流に乗って移動することで、異物や病原体の侵入に備えてパトロールを行っています。また、普段は動き回らない正常な細胞ががん化したがん細胞は高い運動能力を獲得し、組織内へと潜り込み (浸潤)、血管内へと移動することで血流に乗って他の組織へと転移します。このような細胞運動を行うためには、細胞は自身の形態をダイナミックに変形させ、細胞の足として機能する仮足を形成する必要があります。
細胞の形を制御するうえで重要なのが、アクチンと呼ばれる細胞骨格タンパク質の 1 つです。アクチンは、1 つ 1 つがビーズのように繋がる (重合する) ことで繊維状になり、アクチン細胞骨格を形作ります。このアクチン細胞骨格は細胞の形質膜[1]を内側から支える形で張り巡らされており、細胞の形を決めています (図1)。
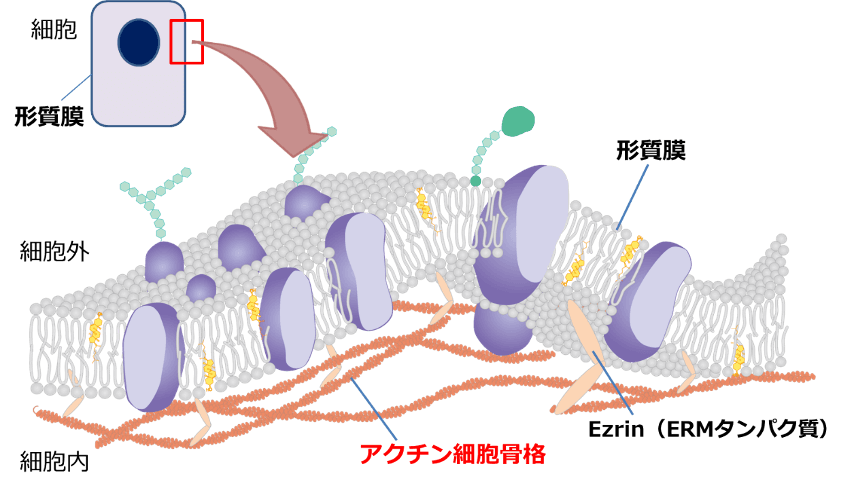

さらに、形質膜の裏側でアクチン細胞骨格が重合して伸びることで、形質膜は内側から押されて突起状に伸長し、アクチンに富んだ糸状仮足や葉状仮足と呼ばれる仮足を形成します。糸状仮足や葉状仮足は主に細胞が平面の上を広がるように運動する際に形成される構造体で、これらを用いる運動様式は間葉系運動と呼ばれます (図2)。
一方、がん化した上皮細胞[2]が血管へと至る道中には、コラーゲン繊維などが密に固まった細胞外マトリックスと呼ばれるゼリーのような基質が存在します。つまり、がん細胞が血管内へ潜り込むためには、細かい網目の中を縦方向に潜っていく必要があり、このような 3 次元環境下では、細胞は“足“をコラーゲンなどの繊維の隙間の中に伸ばし、細胞の形をくびれさせながら網目の中をかい潜るようにして移動する必要があります (図2)。
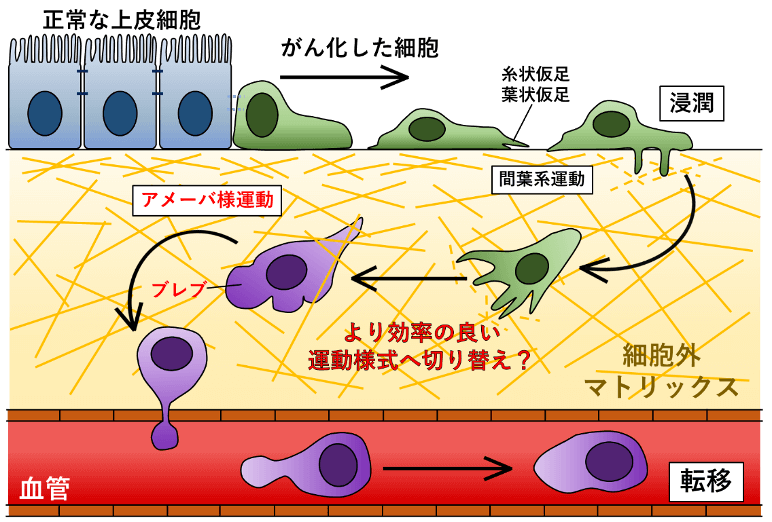

しかし、糸状仮足や葉状仮足は硬いアクチン細胞骨格に裏打ちされているため、細胞の形を柔軟に変形させながら細胞外マトリックス内を運動するには不向きです。そのため、細胞外マトリックス内を運動するには、細胞の形質膜を裏打ちする硬いアクチン細胞骨格を一時的に無くし、柔軟に変形可能な柔らかい形質膜領域を作る必要があると考えられます。
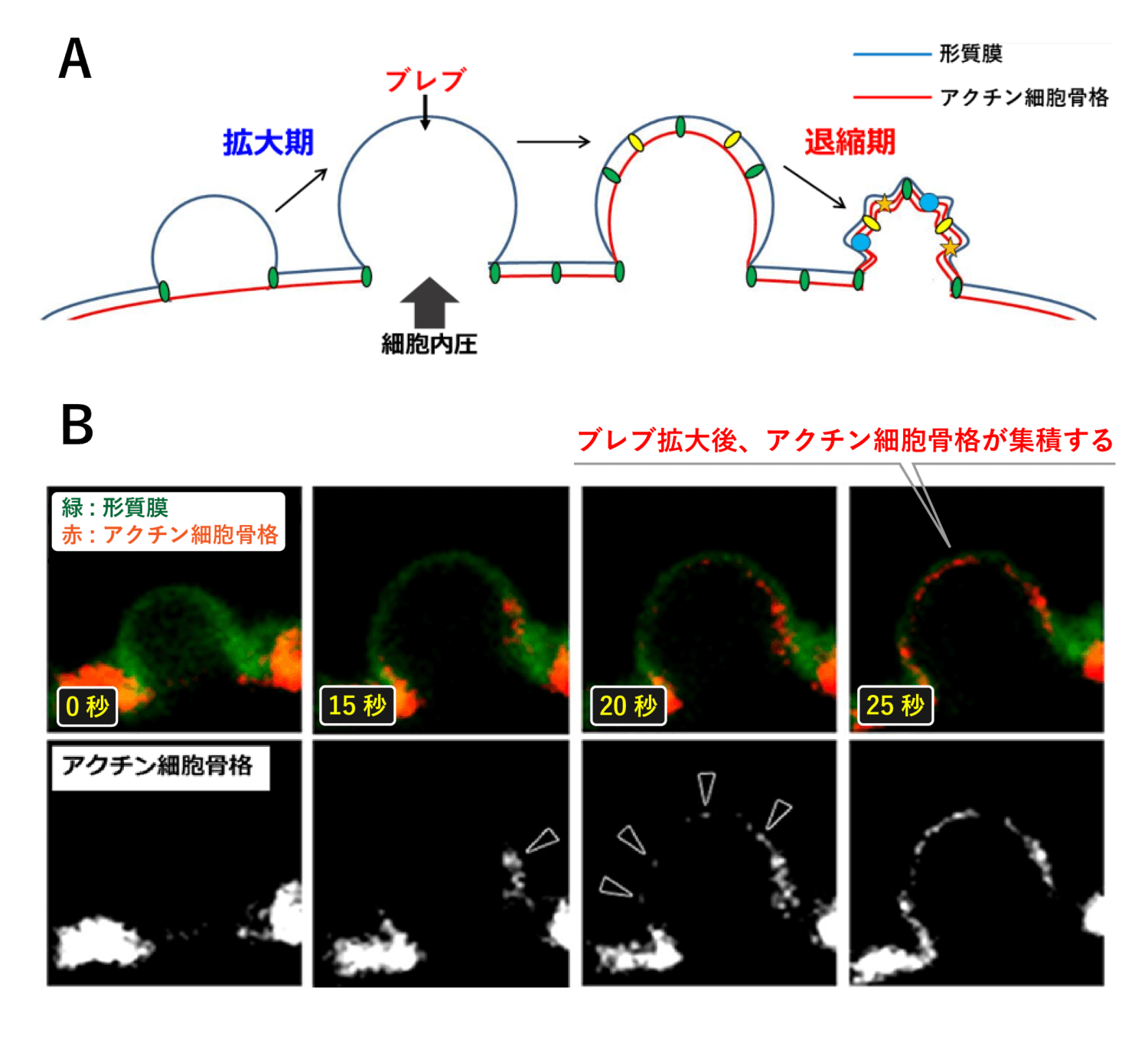
近年の研究で、がん細胞は、ブレブと呼ばれるアクチン細胞骨格を持たない形質膜の突起を活発に形成することで、この問題を解決していることが分かってきました。通常、アクチン細胞骨格は Ezrin を始めとした ERM タンパク質[3]と呼ばれる分子群に繋ぎ留められることで、形質膜を裏打ちしています (図1)。しかし、何らかの要因により形質膜がアクチン細胞骨格から外れてしまうと、アクチンの裏打ちを失った形質膜は細胞にかかる圧力により風船のように膨らみます。このようなアクチン細胞骨格の裏打ちを持たない球状の突起構造が“ブレブ”です (図3)。ブレブはアクチン細胞骨格を持たないため、非常に柔軟な構造であり、細胞の形態を大きく変形させながら拡大します。一度形成されたブレブは急速に拡大を続けますが、アクチン細胞骨格がブレブの形質膜の裏に再び集積し始めます。そして最終的に、ミオシンと呼ばれるモータータンパク質[4]が集まり、アクチンを手繰り寄せて収縮させることでブレブを退縮させます (図3)。

このブレブの拡大と退縮を繰り返すことで、細胞はブレブを仮足として使いながら運動を行うことが近年分かってきました。このようなブレブを用いた細胞運動はアメーバ様運動と呼ばれ、がん細胞は先述した間葉系運動とアメーバ様運動を環境に応じてうまく使い分けながら運動していると考えられています。例えば、がん細胞を平らなプラスチックの培養皿の上で培養すると、糸状仮足や葉状仮足を形成しながら間葉系運動を行いますが、コラーゲンのゲルの中に埋め込んで培養すると、がん細胞は活発にブレブを形成しながらアメーバ様運動を行います。
また、ブレブを自発的に形成するのはがん細胞だけではありません。例えば、脊椎動物の発生過程において、始原生殖細胞はブレブを形成しながら運動し、将来生殖細胞が形成される目的地へと移動することが分かっています。また、土壌中に棲む粘菌類も、ブレブを活発に形成することで土の中をかい潜り運動します。このように、ブレブはがん細胞、正常細胞ともに、幅広い生物種で普遍的に用いられる重要な細胞運動様式であるといえます。
アメーバ様運動を効率的に行うには、まずブレブを拡大させ、ある程度拡大したら退縮させる、という過程を繰り返す必要があります。先に述べたように、ブレブの退縮はアクチン細胞骨格の再集積により制御されており、ブレブの退縮時にアクチン細胞骨格の集積を促す様々なタンパク質が先行研究により分かってきています[5]。
それでは、ブレブが大きく膨張する拡大時には何が起きているのでしょうか? 図4 は、1 つのブレブの拡大から退縮までを並べた連続写真です。ブレブを観察すると、約 20 秒程度という非常に短い時間でブレブが最大まで拡大し、その後約 80 秒かけてゆっくりと退縮していることが分かります。


ブレブの形質膜が急激に拡大すると、その中には細胞の中身である細胞質が急激に流れ込みます。細胞質は様々なタンパク質や、アクチンを始めとした繊維状の細胞骨格が高密度に含まれる液体であり、ゼリーのようにドロドロとしたゲル状の物質であるとみなされてきました。このような、液体がドロドロとして流れにくい状態を、流動性が低い状態と呼びます。しかし、ブレブの中に流れ込む細胞質が硬く流動性の低い状態である場合、先ほど見たようなブレブ拡大時の膜の急激な伸展についていくことができず、結果としてブレブは柔軟に膨らむことはできないと考えられます。それでは、細胞はどのようにして、急激なブレブの拡大を可能にしているのでしょうか?
私たちは、「ブレブが急激に膨らむためには、ブレブの中身の細胞質も柔らかくなる必要があるのではないか」と考えました。つまり、ブレブの拡大時には、形質膜の急速な拡大を可能にするために、ブレブの中でのみ細胞質の性質が変化している、という仮説を立てました。これを確かめるため、私たちは、活発にブレブを形成するヒト大腸がんの培養細胞である DLD1 細胞を用いて実験を行いました。
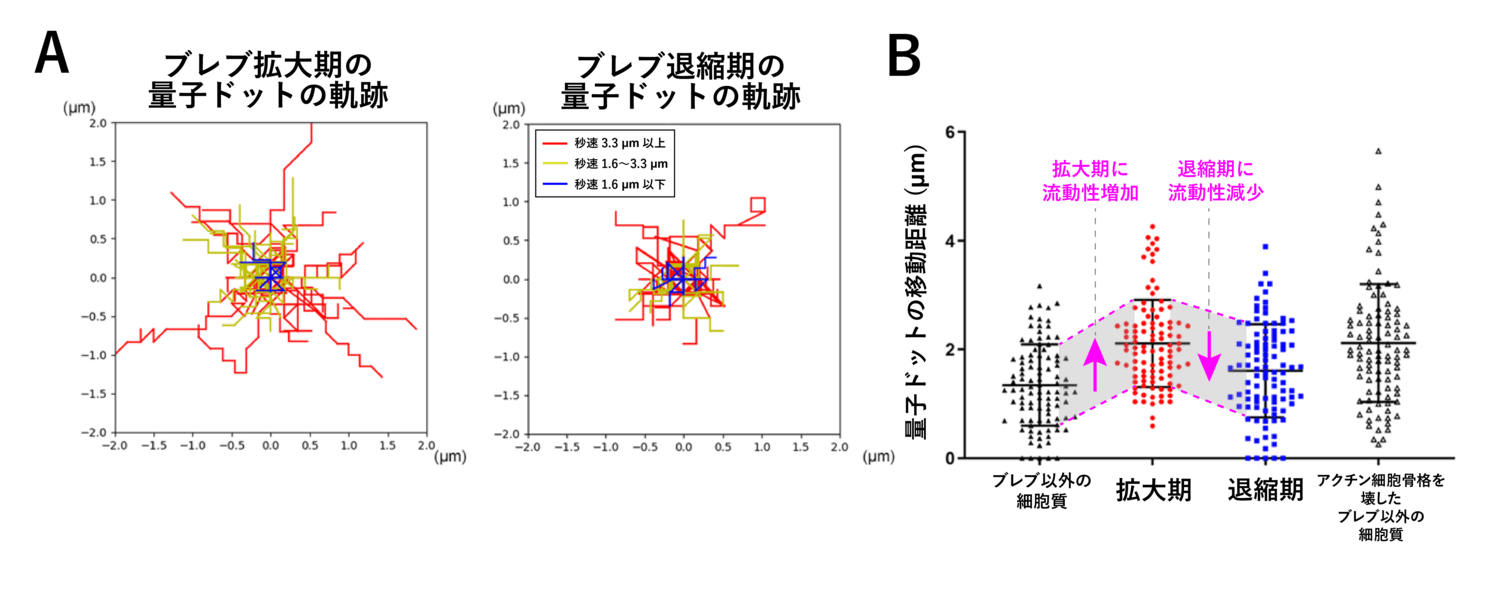
まず、量子ドットと呼ばれる直径 10 ナノメートル程度の非常に小さな粒子を細胞内に取り込ませ、細胞内における動きを追跡することで、細胞質の状態の変化が起きているかを検証しました。もしも細胞質が前述のようにドロドロとしたゲル状で流動性の低い液体であった場合、細胞内の量子ドットはあまり運動しないと考えられます。一方、もし細胞質がサラサラとした流動性が高い液体(ゲル状に対して、こちらはゾル状と呼ばれます)であった場合、量子ドットの運動距離はより大きくなることが予想されます。
実際に量子ドットの挙動を解析した結果、拡大中のブレブ内細胞質は、退縮中と比較して粒子の運動が活発であり、細胞質の流動性が上昇していることが明らかとなりました (図5)。また、ブレブ外の細胞質は非常に流動性が低い状態ですが、アクチン細胞骨格を壊す薬剤 (ラトランキュリン B) で細胞を処理すると、拡大中のブレブ内のように流動性が大きく上昇しました (図5 B)。

 量子ドットをブレブ内へ効率よく導入する手法を確立するのには非常に苦労しました。
量子ドットをブレブ内へ効率よく導入する手法を確立するのには非常に苦労しました。 量子ドットの追跡 (トラッキング) をはじめとする画像解析では、システム情報科学研究院の内田 誠一 先生の研究グループにご協力いただきました。
量子ドットの追跡 (トラッキング) をはじめとする画像解析では、システム情報科学研究院の内田 誠一 先生の研究グループにご協力いただきました。さらに、様々なタンパク質の挙動を観察していく中で、「ブレブの拡大時にのみブレブ細胞質へ強く集積する」という興味深い局在を示すタンパク質が複数見つかりました。図6 は Mena というタンパク質に蛍光タンパク質を付け、細胞に導入してブレブを撮影したものです。ブレブの拡大時にのみブレブ内が強く光っており、Mena が拡大時のブレブ内に集積していることが分かります。一方、退縮中のブレブでは Mena は徐々に薄まっています。このことから、拡大時のブレブと退縮時のブレブの細胞質は、中身のタンパク質の組成も質的に大きく変化していることが示唆されました。
![クリックやタップで拡大 <dfn class="fig">図6</dfn>:<span class="qrinews-figure-title">ブレブ拡大期にのみ濃縮するタンパク質</span> 緑色蛍光タンパク質を付けた Mena を細胞に発現<a id="note6" href="#foot6" title="遺伝子に書かれた情報に基づいて、細胞内でタンパク質が合成されることを (遺伝子) 発現と言います。あらかじめ細胞の遺伝子を書きかえておけば、元々は合成しないようなタンパク質 (例えば、GCaMP) を発現させることもできます。"><sup>[6]</sup></a>させ、ブレブ内における挙動を観察した。Mena は、拡大中のブレブ内に強く濃縮している (黒矢頭) 一方、退縮時には徐々に薄くなっており (白矢頭)、拡大時・退縮時のブレブ内はタンパク質の組成も大きく変化していることが分かる。<a href="#app1" class="link-to-lower-part"><cite class="article"><span class="i">Aoki et al</span>. (2021)</cite></a> の図を改変。](images/210609/fig6-aed9adf5.png)

 Mena をはじめとした「拡大中のブレブ内にのみ集積するタンパク質」は、これまでの研究で、様々なアクチン制御に関わるタンパク質を観察していくなかで複数見つかってきました。
Mena をはじめとした「拡大中のブレブ内にのみ集積するタンパク質」は、これまでの研究で、様々なアクチン制御に関わるタンパク質を観察していくなかで複数見つかってきました。以上の結果から、細胞の内部はこれまで考えられてきたような均一な液体ではなく、細胞は拡大中のブレブにおいて細胞質の性質 (流動性) やタンパク質の組成を変化させていることが明らかとなりました。ブレブは細胞にかかる圧力によって膨張しますが、細胞質の圧力を効率良くブレブの拡大に利用するためには、これからブレブを形成する部分では細胞質の流動性を上昇させ、一方で、 細胞質の圧力が逃げないようにブレブ以外の領域の細胞質流動性は低いままにする必要があります。今回確認された、ブレブ拡大時のみに起こる細胞質の流動性の上昇により、細胞の急速な形態の変化を可能にしていると考えられます。
では、細胞質の流動性が上昇している拡大中のブレブ内では何が起きているのでしょうか?私たちは、様々なタンパク質やイオンなどの挙動を一つ一つ観察し、ブレブの拡大期のみに興味深い挙動を示すものはないか探索を行いました。その結果、拡大期のブレブ内ではカルシウムイオン濃度が急激に上昇していることを見出しました。
カルシウムイオンと結合すると緑色の蛍光を発する GCaMP というタンパク質を細胞に発現[6]させると、カルシウムイオンが多い場所ほど蛍光が強まるため、細胞内のカルシウムイオンの濃度を可視化することができます。GCaMP を発現させた細胞のブレブを観察すると、拡大時のブレブ内では GCaMP の蛍光が非常に強くなっており、カルシウムイオン濃度が大きく上昇していることが分かりました (図7)。一方、ブレブが退縮し始めると、カルシウムイオンは次第に拡散するように減少していきます。
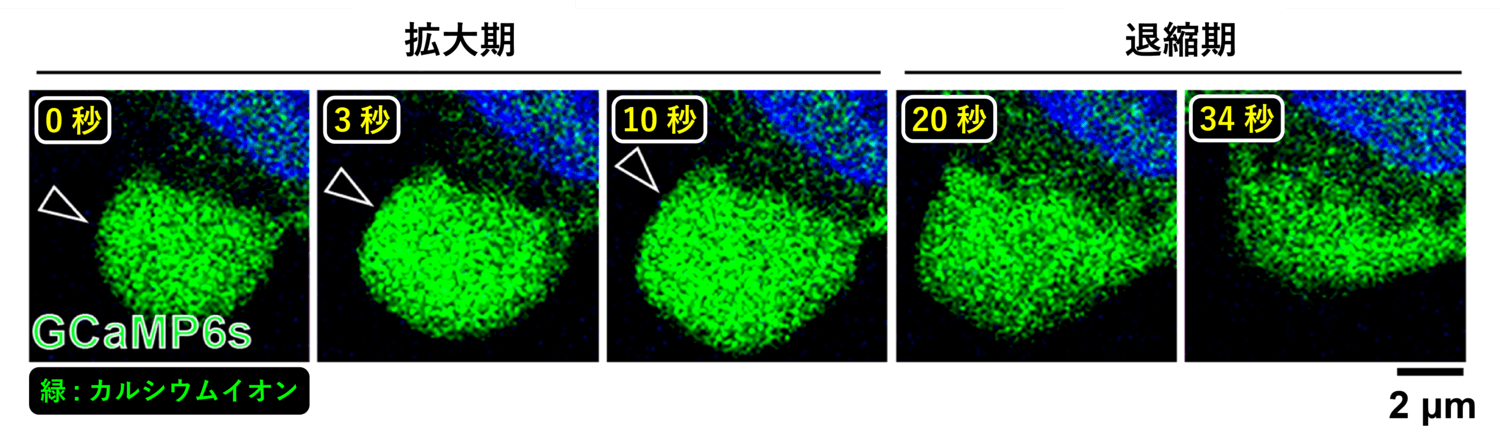

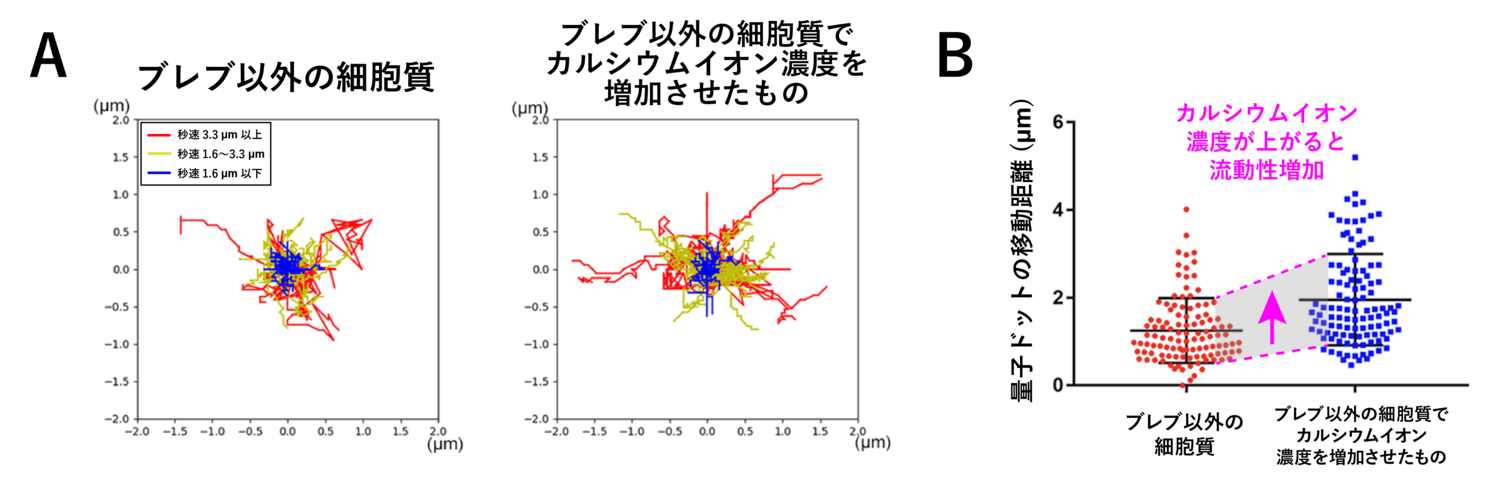
ブレブ拡大期にのみ起こるカルシウムイオンの上昇と、細胞質の流動性上昇に関連があるかを検証するため、細胞内のカルシウムイオン濃度を人為的に変化させ、量子ドットの運動に影響があるかを調べました。細胞外のカルシウムイオンを細胞内へ透過させることで[7]、細胞内全体のカルシウムイオン濃度を上昇させる薬剤であるカルシウムイオノフォアで細胞を処理すると、ブレブ外の (流動性の低い) 細胞質でも量子ドットの運動が活発になり、流動性が上昇することが分かりました (図8)。

さらに、カルシウムイオン濃度が細胞全体で上昇した細胞は、ブレブが拡大した状態のまま退縮できなくなり、大きく膨らんだまま停止する様子が観察されました (図9)。逆に、カルシウムイオンが含まれていない培地中で培養し、細胞内のカルシウムイオン濃度を低下させた細胞では、ブレブは大きく膨らむことができずすぐに退縮してしまい、結果として小型化する様子が観察されました (図9)。
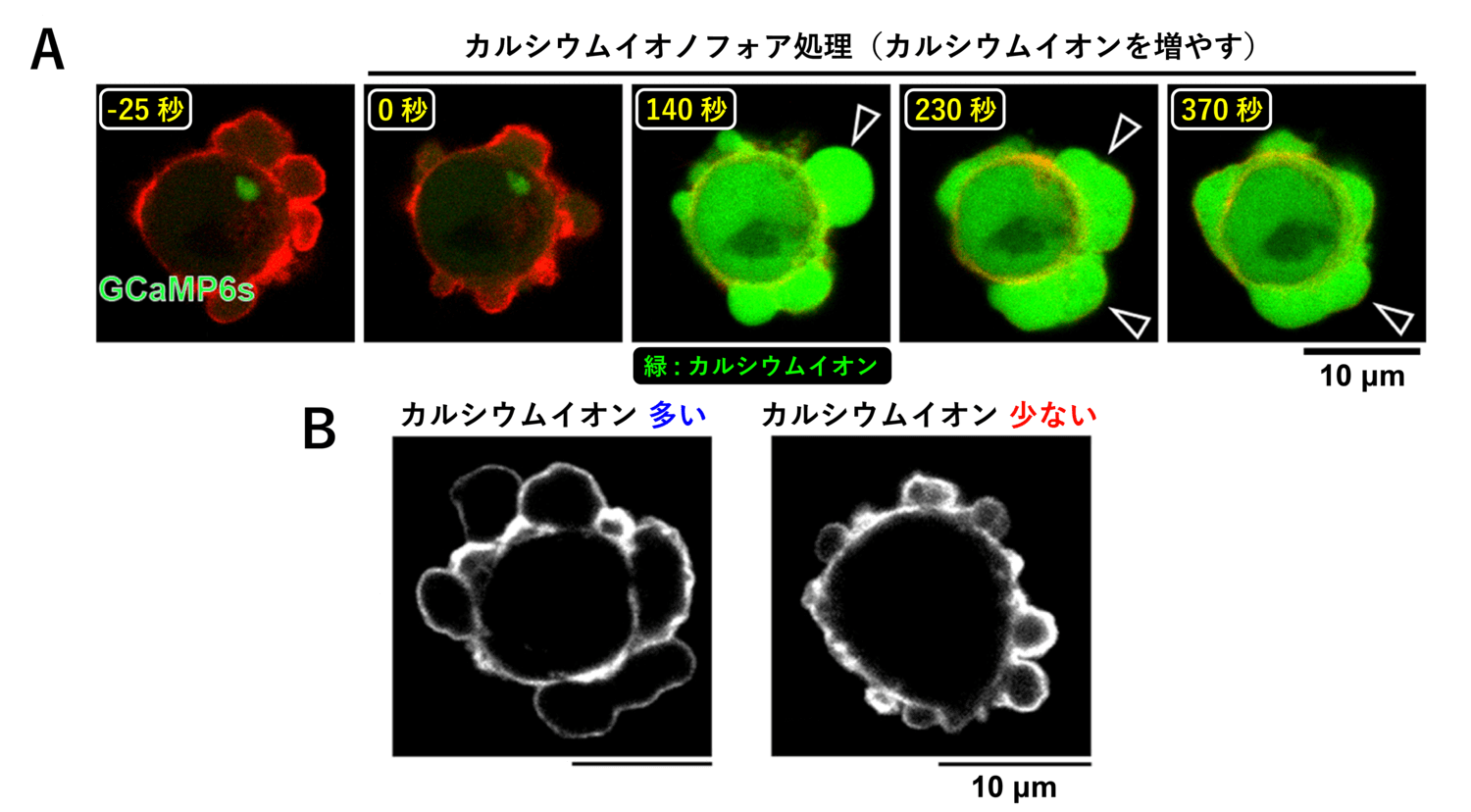

以上の結果から、拡大時のカルシウムイオン濃度の上昇により、細胞質の流動性が上昇していることが分かります。さらに、カルシウムイオン濃度が常に高いとブレブは拡大したままになり、逆に常に低い状態ではブレブがほとんど拡大できなくなることから、カルシウムイオン濃度上昇による細胞質の流動性の上昇は、ブレブを拡大させるために必須であることが明らかになりました。
ここまでの結果から、細胞は拡大時のブレブ内でのみカルシウムイオン濃度を上昇させることで、細胞質の流動性を上昇させ、ブレブの急激な拡大を可能にしていることが分かりました。では、細胞はどのようにして拡大時のブレブでのみカルシウムイオン濃度を上昇させているのでしょうか?
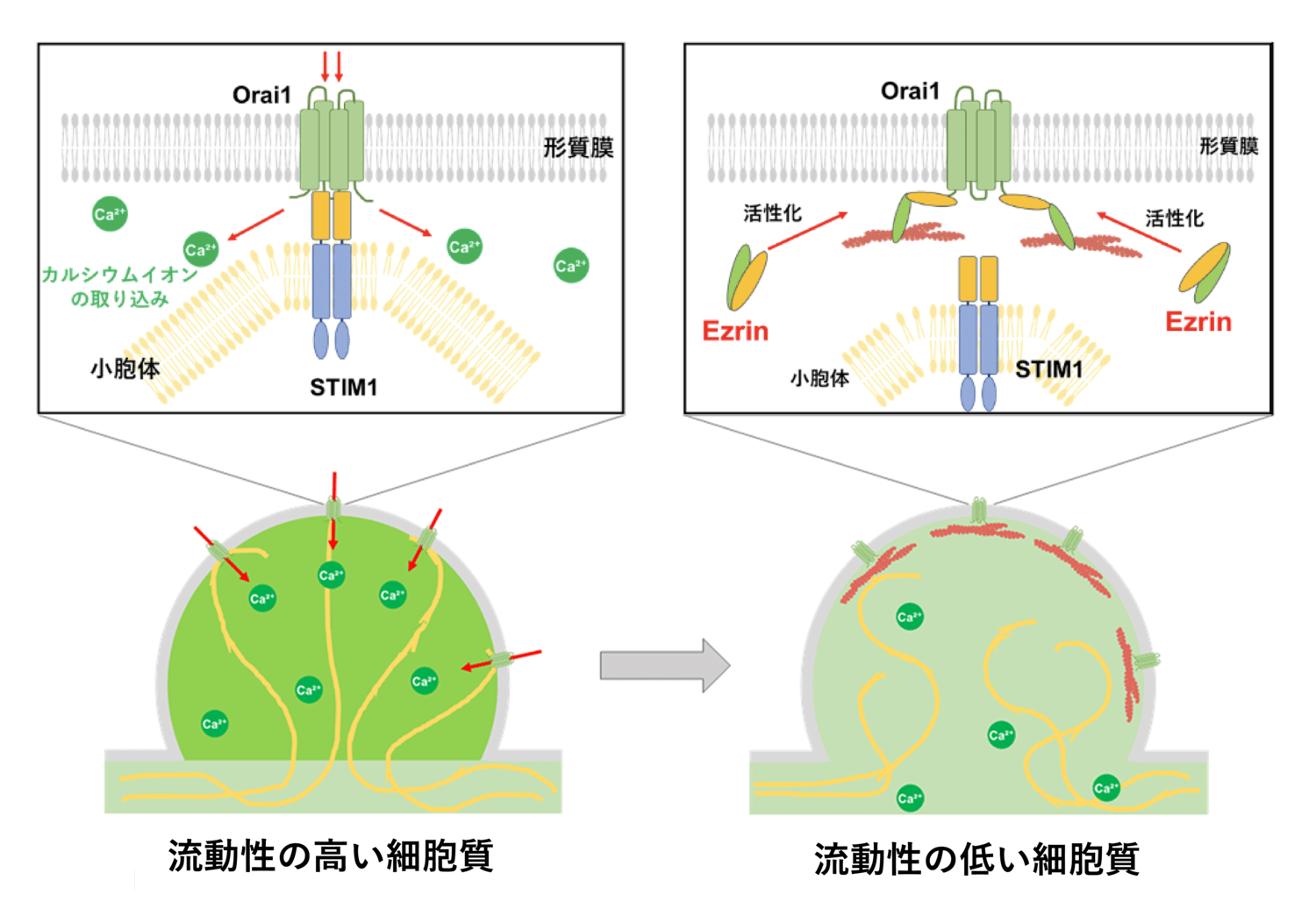
ここで、細胞内におけるカルシウムイオンの制御メカニズムについて考えてみましょう。カルシウムイオンは、細胞内での様々な機能制御において非常に重要なイオンの一つです。細胞質中のカルシウムイオンは、細胞外と比べて非常に低い濃度で保たれています。その一方で、細胞は小胞体という細胞内小器官の中にカルシウムイオンを高濃度に貯蔵しています。そして細胞は必要に応じて、小胞体に貯め込んだカルシウムイオンを放出する、または細胞の外からカルシウムイオンを取り込むことで、細胞質中におけるカルシウムイオン濃度を上昇させます[8]。
ブレブ拡大時におけるカルシウムイオン濃度の制御メカニズムを探るため、私たちはまず、カルシウムイオンの貯蔵庫として機能する小胞体の挙動を観察しました。小胞体は細胞質内では長いヒモ状の構造として観察されますが、興味深いことに、ブレブ拡大時にのみ小胞体と形質膜が接触している様子が観察されました (図10)。
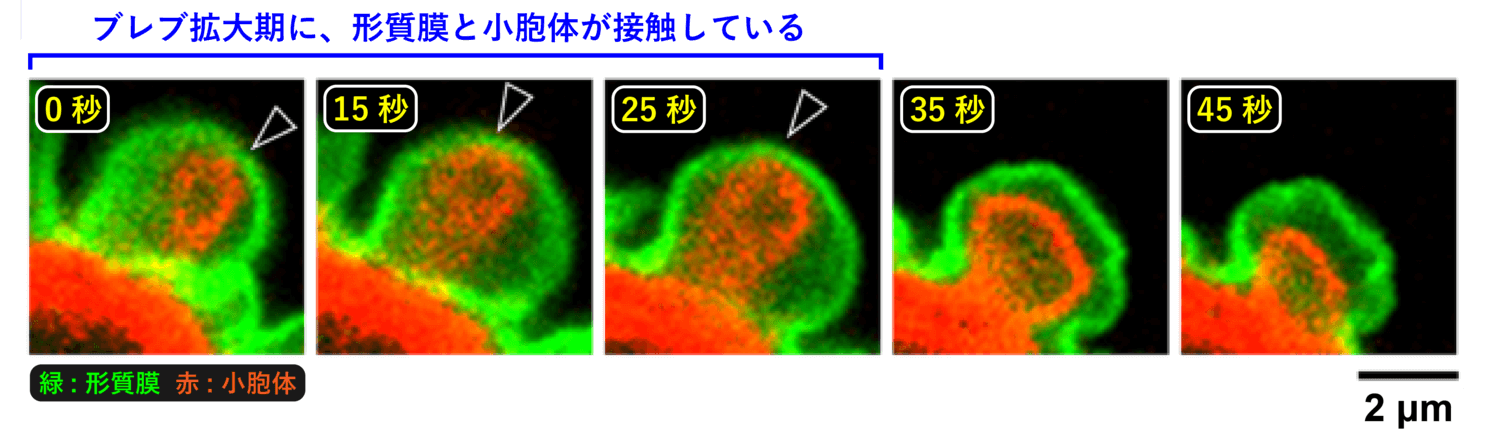

このような、形質膜と小胞体が接触している領域 (形質膜 - 小胞体コンタクトサイトと呼ばれます) では何が起きているのでしょうか?実は、この領域は、細胞内におけるカルシウムイオンの制御にも重要であることが分かっています。先に述べたように、小胞体はカルシウムイオンの貯蔵庫として機能しているため、小胞体内のカルシウムイオンが減少した場合、細胞は外からカルシウムイオンを取り込んで補おうとします。そのために、小胞体内のカルシウムイオン量を検知するセンサーとして、STIM1 というタンパク質が小胞体の膜上に存在します。STIM1 は小胞体内のカルシウムイオン濃度の減少を検知すると活性化し、互いに集合することで Orai1 というタンパク質と結合可能になります。Orai1 は形質膜表面に存在し、細胞外からカルシウムイオンのみを取り込む門のようなタンパク質[9]ですが、普段は閉じています。小胞体の STIM1 が形質膜の Orai1 と結合することで小胞体と形質膜が接触し、Orai1 が開いて細胞外から細胞内へカルシウムイオンを取り込みます (図11)[10]。
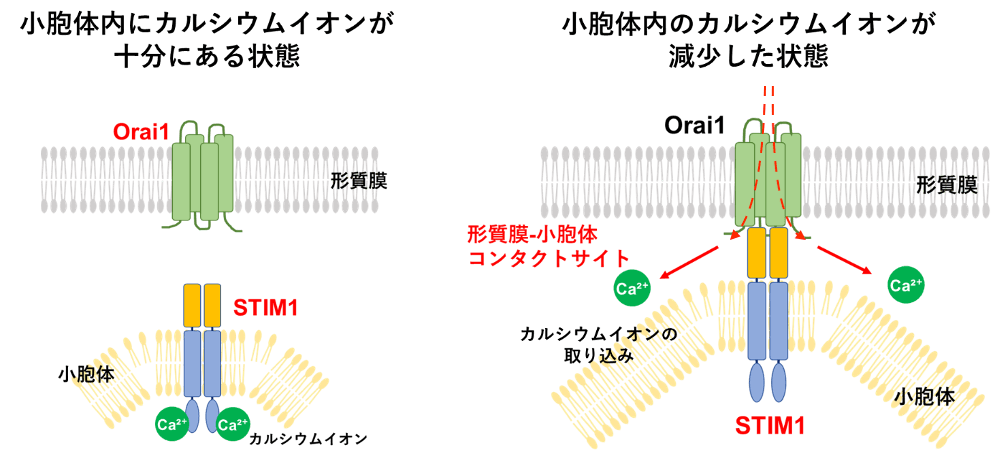

 一口に「カルシウムイオン濃度の上昇」といっても、カルシウムイオン量を制御する分子は細胞内に数多く存在します。今回は、「小胞体と形質膜が接触する」という特徴的な現象が観察できたため、STIM1 と Orai1 が関与する可能性に絞り込んでいくことができました。
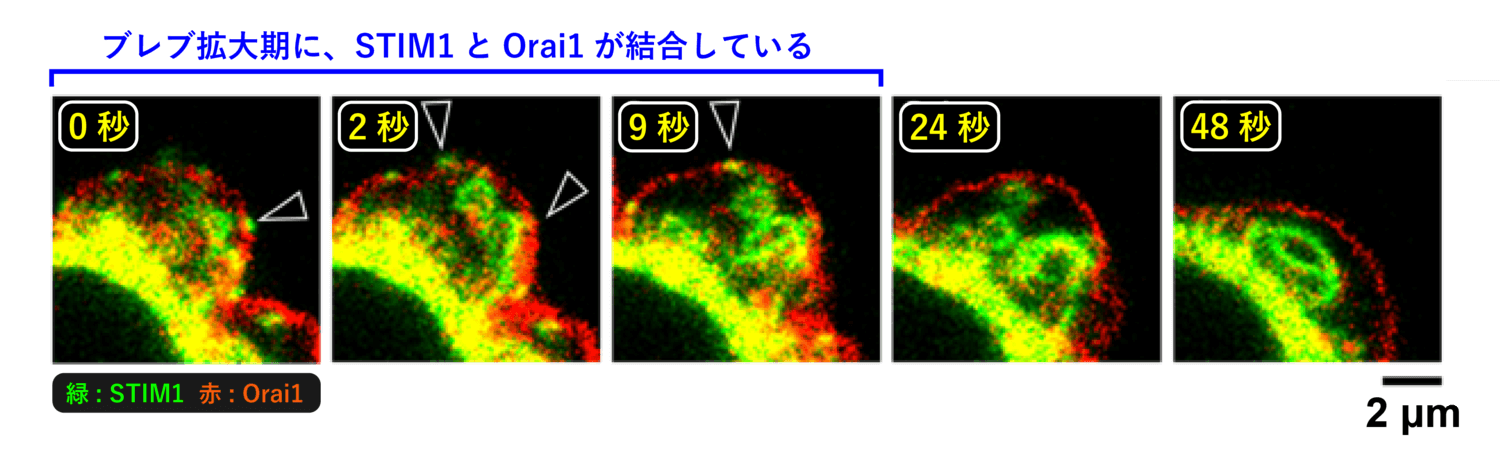
一口に「カルシウムイオン濃度の上昇」といっても、カルシウムイオン量を制御する分子は細胞内に数多く存在します。今回は、「小胞体と形質膜が接触する」という特徴的な現象が観察できたため、STIM1 と Orai1 が関与する可能性に絞り込んでいくことができました。実際に STIM1 と Orai1 の局在を観察すると、ブレブ拡大時にのみ 2 者が同じ場所に存在しており、形質膜-小胞体コンタクトサイトで STIM1 と Orai1 が結合していることが分かりました (図12)。

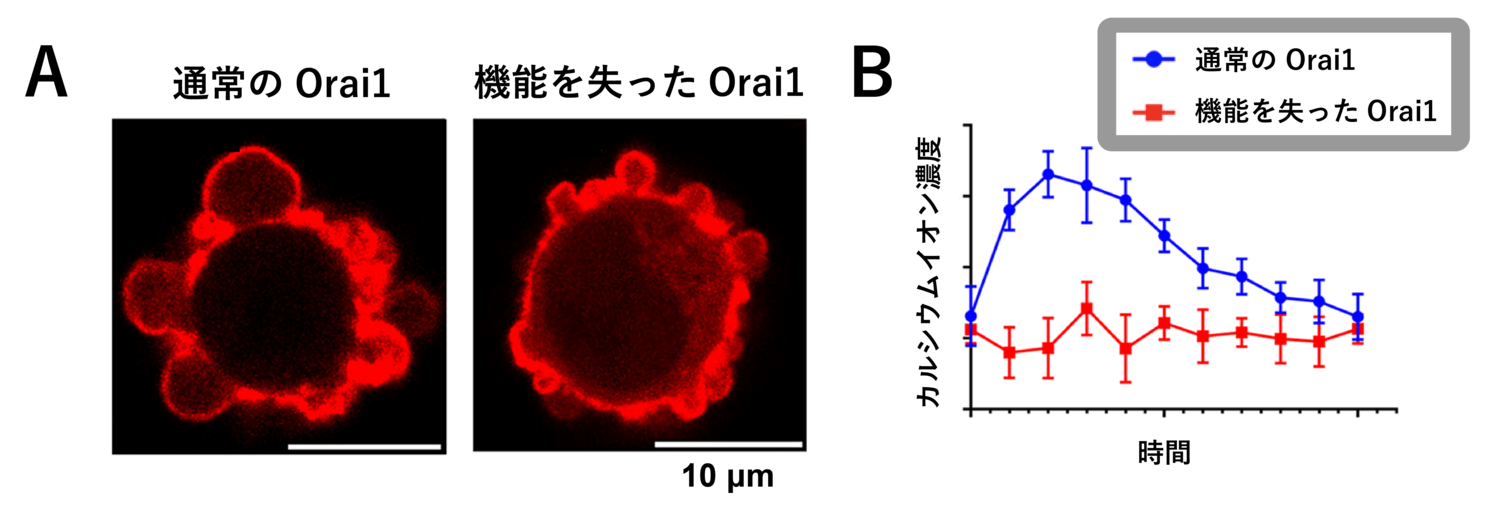
また、Orai1 の機能を失った (カルシウムイオンを外から取り込むことができない) 変異体を細胞に導入すると、ブレブ内のカルシウムイオン濃度は上昇しなくなり、ブレブは拡大することができず小型化しました (図13)。

 逆に、「常に活性化したままの STIM1」を細胞に導入すると、ブレブの拡大が長続きし、より大きく膨らむようになりました。
逆に、「常に活性化したままの STIM1」を細胞に導入すると、ブレブの拡大が長続きし、より大きく膨らむようになりました。以上の結果から、ブレブの拡大時には STIM1 と Orai1 が結合し、Orai1 が開いてカルシウムイオンをブレブ内へ取り込むことで、カルシウムイオン濃度が急激に上昇することが明らかになりました。
ここまで見てきたように、ブレブ拡大時には STIM1 と Orai1 が結合し、細胞外からブレブ内へとカルシウムイオンを取り込みます。一方で、ブレブが退縮し始めると STIM1 と Orai1 の結合は外れ、カルシウムイオン濃度は徐々に低下し、アクチン細胞骨格が形質膜の裏に再び集積していきます。それでは、何がブレブの退縮時に STIM1 と Orai1 の結合を解除しているのでしょうか?
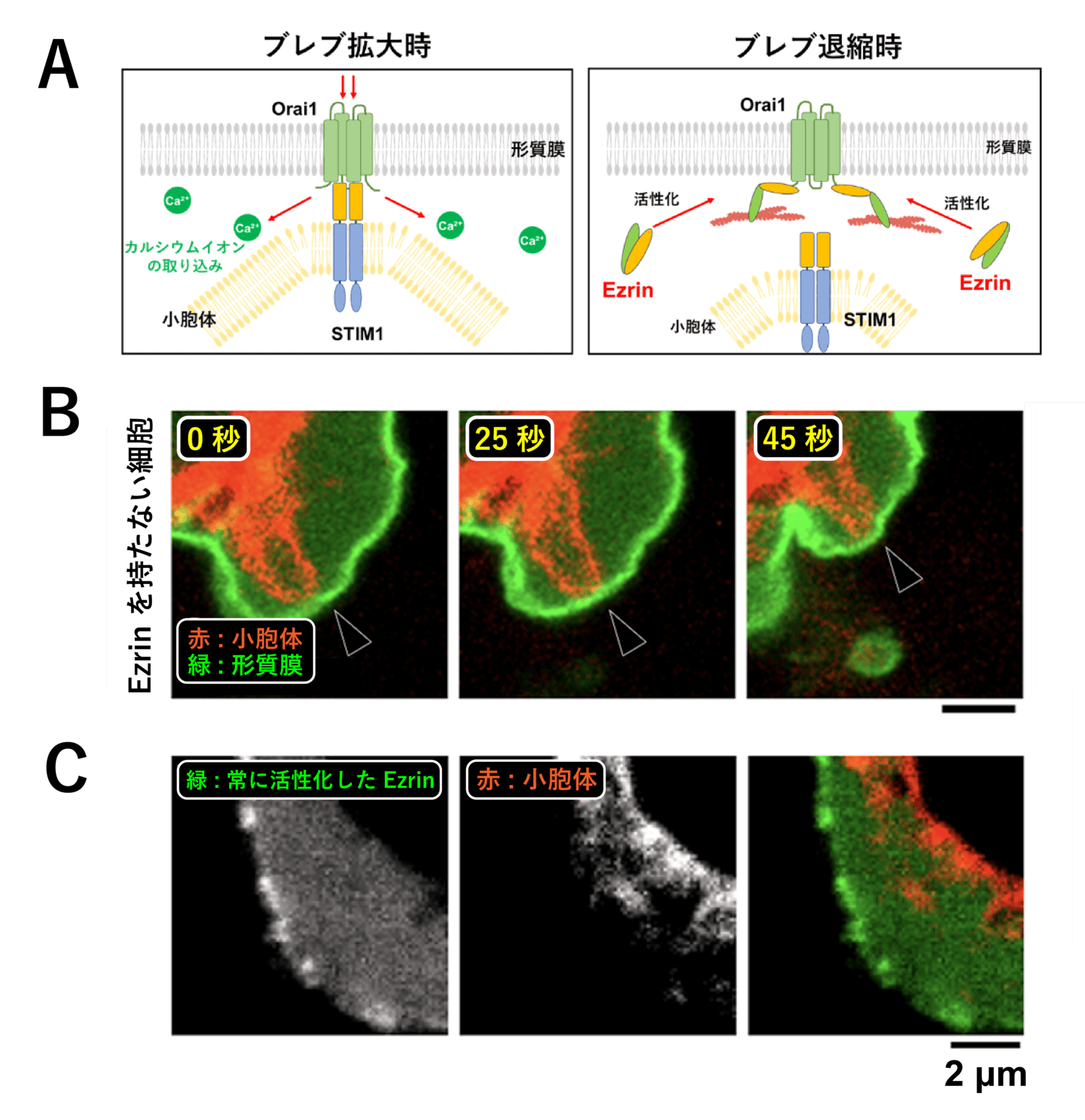
様々な分子の機能について検討した結果、アクチン細胞骨格と形質膜を繋ぐ分子群である ERM タンパク質の 1 つ、Ezrin が、活性化するとSTIM1 よりも強く Orai1 と結合することを見出しました (図14 A)。Ezrin は、ブレブの拡大時には不活性化していますが、退縮時にアクチン細胞骨格が再びブレブ形質膜の裏側に集積し始めると活性化し[11]、図1 に示したように形質膜とアクチン細胞骨格を繋ぎとめていきます。
実際に Ezrin を全く持たない細胞 (ノックアウト細胞) を作成して小胞体を観察すると、小胞体が形質膜に接触したままになり、ブレブの拡大が長く続いて大型化する様子が観察されました (図14 B)。また、Ezrin が常に活性化したままになっている細胞では、逆に小胞体が形質膜と全く接触せず、ブレブも拡大できなくなりました (図14 C)。このことから、ブレブの退縮時に活性化した Ezrin が、STIM1 を押しのけて Orai1 と結合することにより、STIM1 と Orai1 の結合が解除され、結果としてカルシウムイオンの流入が停止することが示唆されました。

今回、細胞はブレブが形成される部位で、局所的に細胞質の柔らかさを大きく変化させていることが分かりました (図15)。これまで、細胞質は均質な溶液であるとみなされてきましたが、この研究により、細胞は細胞質の「流動性」という性質の不均一さを生み出すことで、運動に役立てていることが初めて明らかになりました。
先に述べたように、がん細胞の浸潤・転移時にはブレブを用いた柔軟性のある運動が必要であることが分かっています。従って、今回見出された細胞質の流動性/柔らかさを変化させるメカニズムを検証することで、がん細胞の転移を防ぐ新たな治療法の開発に繋がることが期待できます。

 私がブレブの研究に取り組み始めたのは修士1年の頃でした。それまで見てきた、培養皿にじっと張り付く細胞と全く違い、大きな突起を出したり引っ込めたりしながら活発に動く DLD1 細胞を見て、「どうしてこの細胞はこんなに活発に変形できるんだろう?」と驚いた記憶があります。
私がブレブの研究に取り組み始めたのは修士1年の頃でした。それまで見てきた、培養皿にじっと張り付く細胞と全く違い、大きな突起を出したり引っ込めたりしながら活発に動く DLD1 細胞を見て、「どうしてこの細胞はこんなに活発に変形できるんだろう?」と驚いた記憶があります。 細胞をじっくり見ていると、人間と同じように細胞 1 つ 1 つに個性があり、同じ種類の細胞であってもブレブの形や分子の挙動にも少しずつばらつきがあることが分かります。その中から、どの細胞にも共通して存在する普遍性を見つけ出すために、ひたすら顕微鏡を通して細胞と向き合い、観察を重ねてきました。
細胞をじっくり見ていると、人間と同じように細胞 1 つ 1 つに個性があり、同じ種類の細胞であってもブレブの形や分子の挙動にも少しずつばらつきがあることが分かります。その中から、どの細胞にも共通して存在する普遍性を見つけ出すために、ひたすら顕微鏡を通して細胞と向き合い、観察を重ねてきました。 本研究が論文として形になるまでには長い時間がかかり、その間大変なこともたくさんありましたが、初めてブレブを見た時に抱いた疑問に 1 つの答えを出すことができて嬉しいです。
本研究が論文として形になるまでには長い時間がかかり、その間大変なこともたくさんありましたが、初めてブレブを見た時に抱いた疑問に 1 つの答えを出すことができて嬉しいです。
Note:
より詳しく知りたい方は・・・