

燃料電池などで使われる「イオン液体」を水に溶かし「界面活性剤」として使った場合、従来の界面活性剤とは違いはなんだろうか。理学研究院の松原助教らは、代表的なイオン液体の1つであるイミダゾリウム型イオン液体の界面では、界面活性剤と結合しているはずの臭化物イオンがBF4イオンに押し出されて分離していることを明らかにした。Colloids and Surfaces Aに発表した。
塩とは、陰イオンと陽イオンがイオン結合した化合物である。例えば食塩として知られる塩化ナトリウム(NaCl)は、ナトリウムイオンと塩化物イオンが結合した塩である。
NaClのような一般的な塩は、水に溶かすと陽イオンと陰イオンに分離して電気を通すようになる。しかし、融点が高く室温では固体(結晶)状態にあって電気の伝導率が悪いため、応用的な利用が難しいという欠点があった。
そこで近年になって、電気伝導率の高いイオン液体という物質が注目されるようになった。
イオン液体は、融点が低く室温でも液体で存在する塩のことをいう。イオンの濃度が非常に高いので電気伝導度が高く、また水よりも電気分解しにくく高い電圧をかけられるため、リチウムイオン電池や燃料電池などの分野で利用されている。
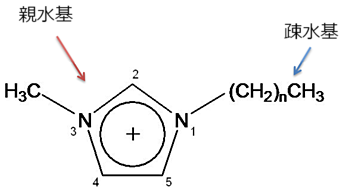
イオン液体となる塩の陽イオンには、大きく分けてイミダゾリウム型のイオンとピリジニウム型のイオンの2種類があり、例えば図1に示したイミダゾリウム型のイオンのように、比較的大きな有機イオンを使うことによって融点が低くなり、室温付近で液体となる。
イミダゾリウムは水になじみやすい部分(親水基)と油になじみやすい部分(疎水基)をもつため、水溶性と油溶性のどちらの物質も溶かすことができる溶媒としても注目されている。親水基と疎水基を両方持つ物質は、一般に「界面活性剤」と呼ばれ、洗剤などこちらも多くの分野で利用されている。
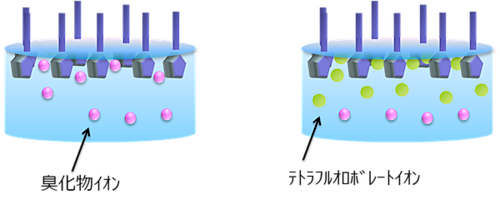
イミダゾリウム型の陽イオンと臭化物イオンでできた水溶液では、表面にイミダゾリウムイオンが並んで膜を形成し、臭化物イオンはイミダゾリウムの親水基と強く相互作用して表面の近くまで接近したものと、水溶液の内側で親水基と弱く相互作用したものとに分かれる(図2左)。
この塩は室温では固体だが、臭化物イオンをテトラフルオロボレートイオン(BF4イオン)に変えるとイオン液体になることが知られている。
特殊な性質を持ったイオン液体を界面活性剤として使ったとき、表面にできる膜の性質は従来の界面活性剤とどのように違うのだろうか。
松原助教らは、水溶液表面での対イオンの分布を調べるために、X線を表面で全反射させる表面全反射XAFS法を用いた。X線を水溶液の表面で反射させるこの方法を使うことで、表面にどのイオンがどれくらいあるかを調べることができる。
実験の結果、臭化物イオンとテトラフルオロボレートイオン(BF4イオン)を混合すると、臭化物イオンは水溶液表面にはほとんどなく、水溶液の内側だけに存在することが分かった。
これは、BF4イオンとイミダゾリウムの親水基との相互作用が強いために、BF4イオンに親水基の近くを独占されてしまうからだと考えられる(図2右)。
イオン液体は陽イオンと陰イオンの相互作用が弱いことが原因で融点が低いはずなので、イミダゾリウムイオンと相互作用の強い臭化物イオンがBF4イオンに排斥されてしまう実験結果は一見不思議に思える。
しかし溶媒である水分子を含めて考えたとき、分子やイオン間の相互作用の強さが、「(a) 臭化物イオン–水 > (b) 臭化物イオン–イミダゾリウムイオン > (c) BF4イオン–イミダゾリウムイオン > (d) BF4イオン–水」のような関係になっていれば説明できる。
(b) > (c)より、イミダゾリウムイオンはBF4イオンよりも臭化物イオンと強く相互作用する。しかし臭化物イオンを中心に考えると、(a) > (b)よりイミダゾリウムイオンとの相互作用は水分子よりも弱い。
よって臭化物イオンとBF4イオンが同時に存在すると、臭化物イオンはイミダゾリウムイオンを離れ、BF4がイミダゾリウムイオンの近くに移動するとと考えられる。
イオンや分子の間の相互作用は、それらがどんな溶媒の中で起こるのかによって大きく異なってくる。イオン溶液と界面活性剤という組み合わせでは、溶媒の中で複雑な相互作用が起こるため、その理解には「熱力学」や「統計力学」の手法を用いていろいろな情報を実験結果から導き出す必要がある。
松原助教は、「現在、溶液の表面張力を測定し、それに独自に導出した熱力学式を適用して表面や溶液の構造を評価することで、実験結果を確かめている」と話す。
より詳しく知りたい方は・・・