

九州大学大学院理学研究院の磯田研究員らの研究グループは、脊椎動物未受精卵の分裂停止の仕組みを分子レベルで初めて解明しました。不妊の新しい診断や治療法の開発につながるものと期待されます。本研究成果は、2011年9月12日に米国の科学雑誌Developmental Cellに掲載されました。
人間をはじめとする脊椎動物の未受精卵は、排卵後に第二減数分裂の中期(Meta-II)で分裂を停止して受精を待ちます。この分裂の停止(Meta-II停止)は、未受精卵が精子なしで発生してしまうのを防ぐために不可欠です。
マウスを用いた実験では、Meta-II停止を起こさない受精卵からは奇形腫などが生じるという知見があります。このことからも、Meta-II停止は脊椎動物の生殖において非常に重要な過程であることがわかります。
研究グループの代表である佐方教授らはこれまで、カエルの未受精卵を用いた研究により、「Emi2」や「Cdk1」と呼ばれるタンパク質、および「Mos-MAPK経路」と呼ばれる分子経路が分裂停止に重要な役割をはたすことを明らかにしています。
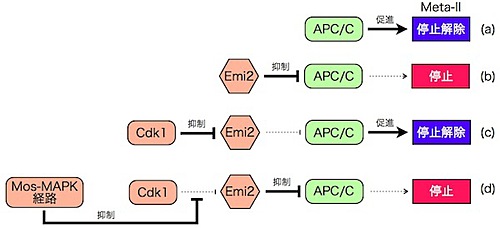
受精後、Meta-II停止の解除に関わるのは「APC/C」と呼ばれる促進因子です(図1a)。「Emi2」は安定化・活性化されると、このAPC/Cの働きを抑制し、未受精卵のMeta-II停止を引き起こします(図1b)。
「Cdk1」は、Emi2を不安定化・不活性化させます。不活性化したEmi2はAPC/Cの働きを抑制することができず、Meta-II停止が解除されます(図1c)。一方、「Mos-MAPK経路」はCdk1の働きに拮抗することで、Emi2を安定化・活性化させ、Meta-Ⅱ停止を引き起こします(図1d)。
このように、Cdk1はEmi2の働きを抑制し受精後のMeta-II停止解除を引き起こし、Mos-MAPK経路はEmi2の活性化を介してMeta-II停止の維持を行なっています。しかし、Cdk1によるEmi2の不安定化・不活性化、およびMos-MAPK経路によるEmi2の安定化・活性化の分子機構は不明なままでした。
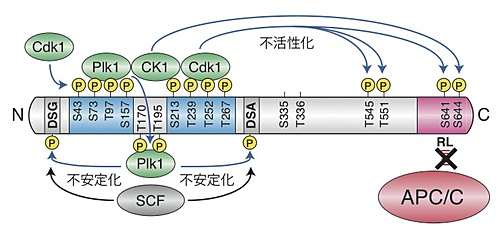
磯田研究員らはアフリカツメガエル卵を用いて、まずCdk1によるEmi2の不安定化・不活性化の機構を解析しました。Cdk1はタンパク質をリン酸化する酵素の一種です。そこで、Cdk1によってリン酸化を受けるEmi2内の部位をリン酸化されないように変化させました。
このEmi2変異体は高い安定性と活性を持ち、未受精卵の分裂後期促進因子であるAPC/Cを強く阻害して、未受精卵をMeta-IIで停止させることが分りました。このことから、Cdk1による特定部位のリン酸化がEmi2を不安定化・不活性化させることが示されました。
また、Cdk1によるEmi2のリン酸化部位にCdk1自身および他のリン酸化酵素(Plk1およびCK1)が結合することを発見しました。これらのEmi2に結合した酵素が、Emi2内の他の部位をさらにリン酸化することでEmi2が不安定化・不活性化することが示されました(図2)。
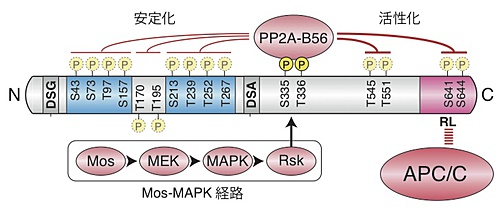
次に、Mos-MAPK経路によるEmi2の安定化・活性化の機構を解析しました。その結果、まずMos-MAPK経路によってEmi2がリン酸化され、このリン酸化部位にタンパク質脱リン酸化酵素の一種(PP2A-B56)が結合することが分りました。
そしてこのPP2A-B56が、上記のCdk1、Plk1、CK1によるリン酸化部位を脱リン酸化することでEmi2を安定化・活性化させることが明らかになりました(図3)。
すなわち、アフリカツメガエル未受精卵内では、Emi2に結合したリン酸化酵素群によるリン酸化が、Emi2に結合したPP2A-B56によって微細に調節されることでEmi2が安定化・活性化され、Meta-II停止が起こることが明らかになりました。
今回の結果から、脊椎動物未受精卵の分裂停止の詳細かつ新奇な分子機構が初めて解明されたことになります。
今後の展開について磯田研究員は「人の不妊や卵巣奇形種の原因の一つとしてMos-MAPK経路の不全やEmi2の変異などの可能性が考えられるため、本研究成果はそれらの予防・診断や治療法開発の足がかりを提供するものと思われます」と話しています。
より詳しく知りたい方は・・・