

細胞内小器官のペルオキシソームは、ベータ酸化や胆汁酸の生合成など生命活動に重要な役割を担っていますが、その形成の制御機構はいまだによく分かっていません。生物科学部門の名城さんらの研究グループは、ペルオキシソームの形成因子であるPex1pとPex6pが、ATPと反応することによってその立体構造が変化し、ペルオキシソームへの正常な輸送が制御されていることを明らかにしました。ペルオキシソーム形成の制御機構解明にむけた足がかりとして期待されます。
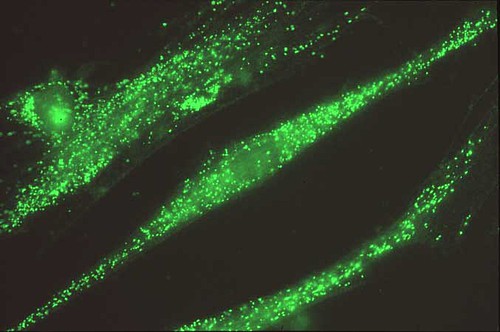
ペルオキシソームは直径0.5~2ミクロンほどの球形の細胞内小器官です(図1)。とても小さいペルオキシソームですが、その中には様々な酵素が含まれており、脂肪酸を分解してエネルギーを取り出すベータ酸化という反応を行ったりコレステロールや胆汁酸の生合成を行うなど、生命活動に重要な役割を担っています。
ペルオキシソームの形成に必要な遺伝子群はPEX遺伝子と呼ばれ、その遺伝子が作る様々な因子を総称してペルオキシンと呼びます。ペルオキシンはリボソームで合成された後、ペルオキシソームへと輸送されて、その形成や維持に用いられます。
ペルオキシンをはじめとした遺伝情報に基づいて合成されるタンパク質は、複雑に折り畳まれた立体構造をとっていますが、常に一定の形をしているのではなく状況に応じて構造を変化させています。そして、そのタンパク質が機能する場所に輸送されて初めて正常に働くことができます。ペルオキシンは現在までに数十種が同定されていますが、その立体構造の変化や輸送の制御機構などに関しては解析が遅れているのが現状です。
名城さんらの研究グループはペルオキシソーム形成の維持機構を明らかにするため、ペルオキシンの中でも、エネルギーのもとであるATPを分解する酵素として報告されているPex1pとPex6pに注目しました。
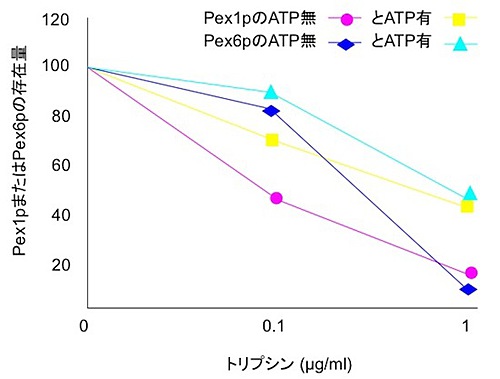
タンパク質の立体構造の変化は直接観察することができません。しかし、もし立体構造が変化すると酵素によって分解される程度が変化します。そこで、ATPの有無によってPex1pとPex6pの立体構造が変化しているかを見るために、ATPを加えた場合と加えなかった場合でタンパク質分解酵素にどれくらい分解されるかを比較しました。
その結果、Pex1pやPex6pにATPを加えた後、タンパク質分解酵素のひとつであるトリプシンでPex1pやPex6pを分解させると、ATPを加えなかったものと比較して分解を受けにくくなりました(図2)。このことから、Pex1pやPex6pがATPと反応することにより立体構造が変化し、トリプシンと結合する部分が隠れ、分解酵素に対する耐性が増したことが示されました。
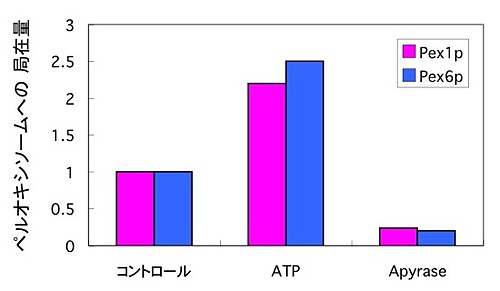
次にPex1pやPex6pが正常にペルオキシソームへと輸送されるかを観察したところ、ATP存在下では効率よくペルオキシソームへと移行しましたが、ATPを枯渇させるとペルオキシソームへ輸送されず、細胞内に散在していました(図3)。
正常な輸送が行われない場合の影響を調べるため、ペルオキシソームの膜上にあるPex1pやPex6pの受容体Pex26pを変異させて、Pex1pやPex6pがペルオキシソームの周りに存在できなくすると、ペルオキシソーム内で働く別のタンパク質が正常に輸送されなくなっていました。つまり、Pex1pやPex6pがペルオキシソームへ輸送されて周りに存在することが正常なペルオキシソーム形成に必須であることが示されました。
以上より、Pex1pやPex6pはATPによって立体構造が変化し、ペルオキシソームへの輸送が制御されていることが明らかになりました。また、Pex1pやPex6pがペルオキシソームの周りに存在することが、ペルオキシソームが正常な機能を果たす上で重要であると考えられます。
名城さんは「今後はATPによってPex1pとPex6pのどの部位がどのように構造変化し、それによってなぜ、ペルオキシソームへ行きやすくなるのかを明らかにしていきたいと考えています」と話しています。
より詳しく知りたい方は・・・