

DNAの損傷を探知し修復するためには、損傷を探知するタンパク質をリン酸化し、その情報を細胞へ伝える別のタンパク質と結合しなければならない。このリン酸化と結合を仲介する酵素がカゼインキナーゼ2であることを明らかにし、DNA損傷情報の伝達の仕組みを再現することに成功した。武石さんらがGenes to Cellsに発表した。
生物の設計図であるDNAは、紫外線をはじめとした様々な要因によって絶えず損傷を受けている。DNAの損傷は遺伝子の変異や細胞の癌化の原因となるため、真核生物の多くは損傷したDNAを探知し修復する仕組みを備えている。
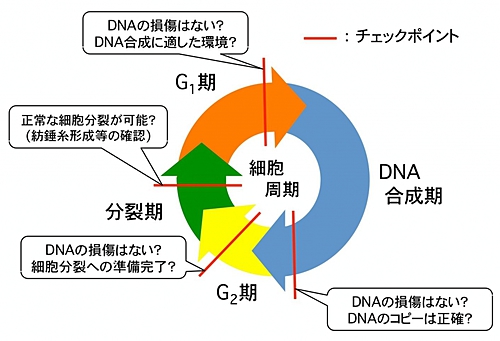
損傷したDNAはセンサータンパク質によって探知され、その情報はTopBP1と呼ばれる別のタンパク質によって細胞増殖を制御するタンパク質へ伝えられる。異常を探知した細胞は増殖をやめてDNAの修復を開始する。
このようにDNAに損傷がないかチェックし、異常がある場合に細胞の増殖を停止する機能を『チェックポイント』という(図1)。
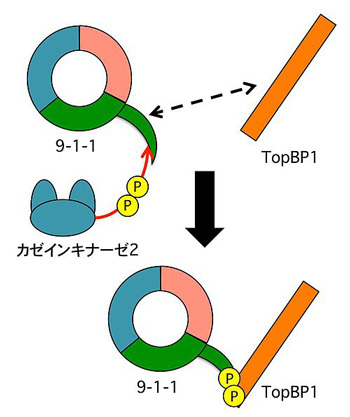
DNA損傷を探知するセンサータンパク質は、Rad9、Hus1、Rad1という3種類のタンパク質集合体であり、それぞれの数字をとって9-1-1と呼ばれる。9-1-1で特に重要なのがRad9のしっぽのような構造である。このしっぽにリン酸基が付加(リン酸化)され、リン酸化された9-1-1がTopBP1と結合することでDNA損傷の情報が伝達されると言われている。
一般的に、タンパク質同士の結合を制御するタンパク質のリン酸化には専用の酵素が必要だが、どんな酵素がRad9のしっぽをリン酸化し、9-1-1とTopBP1をつなぐのかはこれまで分かっていなかった。
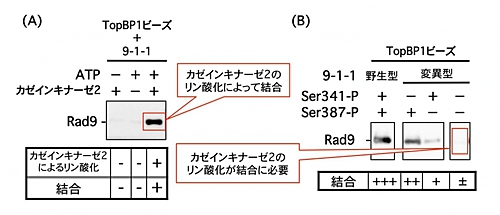
武石さんらがヒト細胞の抽出液を分析したところ、リン酸化酵素であるカゼインキナーゼ2がセンサータンパク質9-1-1に結合していることを発見した。そこで、このカゼインキナーゼ2が未知であったRad9のしっぽをリン酸化する酵素であるか検証するため、精製したカゼインキナーゼ2とRad9を反応させたところ、予想通りRad9のしっぽが2カ所リン酸化され、そのうち1カ所はTopBP1と結合するときにリン酸化が必要な場所であった(図2)。
さらに、全くリン酸化されてない9-1-1にカゼインキナーゼ2を反応させ、TopBP1との結合を試みたところ、9-1-1とTopBP1の結合が再現された(図3A)。また、これまで9-1-1とTopBP1の結合に関係ないと考えられていた9-1-1のもう片方のリン酸化も、TopBP1との結合に関係していることが分かった(図2)。
カゼインキナーゼ2による9-1-1の2カ所のリン酸化が、DNA損傷の情報を伝えているのは間違いないと考えられる。そこで、9-1-1のリン酸化がチェックポイントに必要かを検証したところ、リン酸化できないRad9が多く作られる細胞ではTopBP1との結合がほとんど起きず(図3B)、DNAの損傷が起きると細胞が死にやすいことが分かった。
以上の結果から、センサータンパク質9-1-1のリン酸化にはカゼインキナーゼ2が必要であり、このリン酸化がDNAに損傷を受けた時に起こるチェックポイントの機能に重要であることが明らかとなった。
武石さんは、「カゼインキナーゼ2のような、タンパク質同士の結合を制御する酵素の機能解明は、癌細胞を優先的に殺す抗癌剤の開発につながると期待される。今後はまず、細胞内でいつカゼインキナーゼ2によって9-1-1がリン酸化されているかを解決したい。」と語る。
より詳しく知りたい方は・・・