


光学顕微鏡には細胞を生きたまま観察できるという利点がある一方で、その原理上、拡大できるサイズに限界があることがわかっています。この限界よりもさらに小さなウイルスやタンパク質などの物質の動きを捉えるために、超分解能顕微鏡の開発が世界中で進められています。ナノ物性化学研究室の増田さん(写真中央)の研究グループは、金属微粒子シートの表面にきわめて近い部分で起こる局在表面プラズモン共鳴(LSPR)現象を利用することで、現在最も「薄い」領域の観察に用いられている全反射照明蛍光(TIRF)顕微鏡を超える、約10nmという「ナノ」領域のイメージングに世界で初めて成功しました。研究成果はScientific Reportsに発表されました。
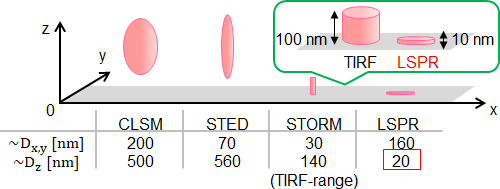
市販の光学顕微鏡、つまり光を使った顕微鏡の最大倍率は1000倍程度ですが、それはなぜでしょうか。実はこれ以上倍率を上げてしまうと、得られる像がぼやけてしまうからです。これを光の回折限界と呼びます。顕微鏡を使って区別することが可能な二つの点の最短距離を分解能と言い、顕微鏡の性能を表します。通常の顕微鏡では光の回折限界により、水平方向(顕微鏡ステージ上の縦横方向)には200nm[1]、垂直方向(奥行方向)には500nmの分解能が限界となっています。
観察したい部分を蛍光色素であらかじめ染色しておき、光を照射したときに現れる発光を観察する蛍光顕微鏡も光学顕微鏡の一つです。蛍光顕微鏡は、染色した細胞やタンパク質などの生体分子を、素早く、生きた状態で、高感度に観察することができ、生物学的研究において欠かせない技術となっています。しかし、蛍光顕微鏡の分解能もまた、回折限界により制限されています。回折限界よりも小さな生体分子は無数に存在し、例えばウイルス(100nm前後)、タンパク質(10nm前後)などの細かな動きを通常の顕微鏡で捉えることはできません。このため、2014年のノーベル化学賞に代表されるように、光の回折限界を超える分解能をもつ超分解能顕微鏡の開発が現在世界中で進められています。
これまでに開発された超分解能顕微鏡を図1にまとめました。回折限界を達成した共焦点レーザー顕微鏡(CLSM)と比較すると、STED顕微鏡およびSTORMでは分解能が改善されているのが分かります。とくにSTORMでは水平方向の分解能を高める技術とは別に、垂直方向の分解能を上げるために全反射照明蛍光(TIRF)顕微鏡を組み合わせています。増田さんの研究グループは、局在表面プラズモン共鳴(LSPR)という現象を利用して垂直方向の分解能を格段に高めることに成功しました。
金や銀などの貴金属は、ナノメートルレベルの大きさになると塊の金属とは異なる特徴をもつようになります。例えば金属微粒子(金属ナノ粒子)とも呼ばれる微小な金属球に光を照射すると、金属表面の自由電子が電場の影響により連続的に振動する現象が起きます。この現象がLSPRと呼ばれるもので、金属表面から粒子の大きさ程度の範囲に強い電場を作り出します(図2a)。また、隣接する二つの粒子の間には、一つの微粒子表面に発生するLSPR同士が結合することでより強い電場を生じることがわかっています。
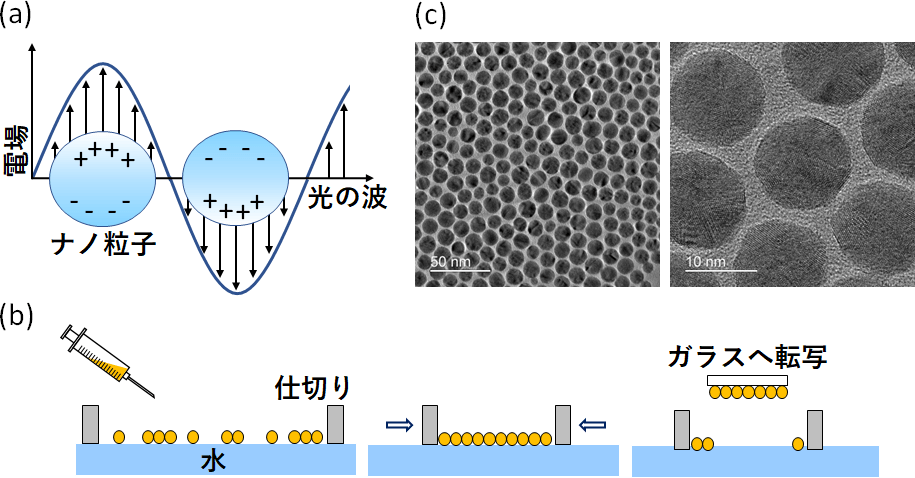

増田さんが所属する玉田・岡本研究室では、金属微粒子を含む溶液を水面に撒き、溶媒が蒸発した後に圧縮することで、金属微粒子が最密構造で並んている金属微粒子シートを作製することに成功しています(図2b, c)。この方法で作った金微粒子シートをガラスへ転写したものを、蛍光顕微鏡用の基板として用いました。
金微粒子の大きさ12nm、粒子間距離3nmのシート表面の、垂線に沿った電場分布がどうなるか、電磁場解析による計算機シミュレーションを行いました(図3a)。強度1の入射光に対して、LSPRの電場強度はTIRF顕微鏡の約50倍になっています。また、電場強度がほぼ0になる垂直距離は、LSPRでは15nm、TIRF顕微鏡では100nmです(図3b)。このことから、LSPRはTIRF顕微鏡と比べて、表面付近の狭い範囲だけに強い電場を励起できるということが確認できました。
ただし金属微粒子を観察に用いる場合、蛍光色素に吸収されたエネルギーの一部が金属に移動し、消光してしまいます。この表面エネルギー移動の効果だけをみると、金微粒子シート付近ではエネルギー移動が大きく蛍光強度は低くなり、金属微粒子シートから離れるとともに蛍光強度は上昇します(図3c点線)。金微粒子シートによって実際に得られる蛍光強度は、LSPRによる電場増強効果と微粒子へのエネルギー移動による消光の割合とをかけ合わせたものとなります(図3c実線)。実際に蛍光強度がもっとも強くなる空間位置は微粒子シート表面よりも内部に存在しますが、表面近くの高い電場部分を利用することで、高感度な界面観察が可能になると考えられます。この結果から、金微粒子シートを利用することで、TIRF顕微鏡よりも狭い、基板から5–10nmの領域を高感度に観察ができるということがわかります。
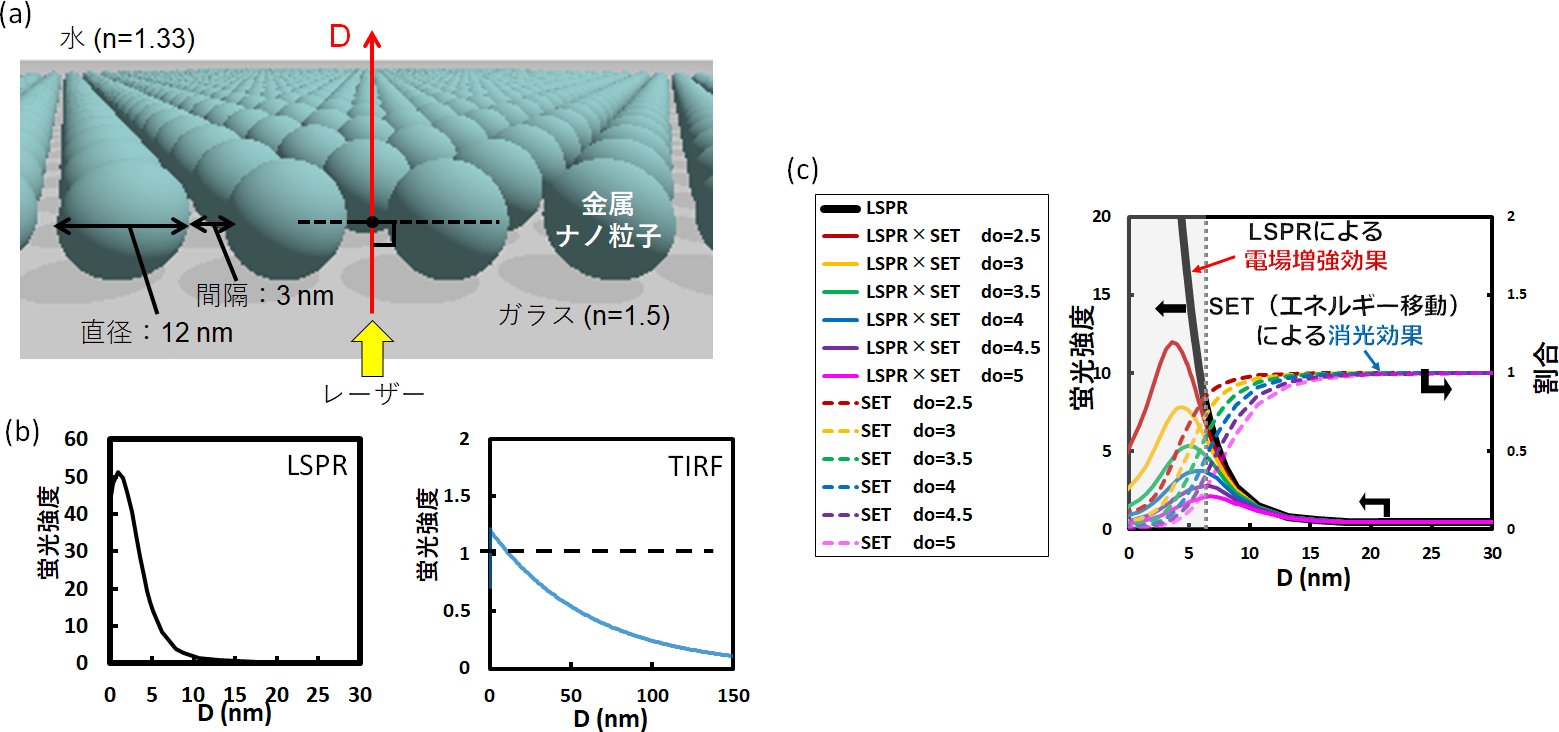

図4a, bは、金属微粒子のLSPRとTIRF顕微鏡によって得られた細胞の蛍光画像です。染色しているアクチンは、細胞膜周辺と接着部分に多く存在しています。TIRF顕微鏡では細胞の外壁部分と接着斑などの接着面の微細構造の全体像が確認できます(図4b)。一方、LSPRでは接着斑のみが観察されています(図4a)。TIRF顕微鏡では基板表面から100nm程度の範囲の蛍光を取得します。これにより、細胞膜が高さ方向に十分な厚さをもち、染色されたアクチンが重なることで、細胞の外壁部分が明るく観察されています(図4c)。LSPRでは、10nm程度の狭い範囲だけの観察を行うため細胞膜の重なりはほとんどなく、細胞の接着部が主に観察されます。このように、金微粒子シートをイメージング基板として用いることで、細胞の接着面のごく狭い領域のみを観察できるようになります。最後にTIRF顕微鏡でガラスと金微粒子シートの境界を観察した結果を図4dに示します。通常のTIRF顕微鏡観察(ガラス上)では細胞全体が明るくなっていますが、金微粒子シート上では接着面の微細構造を確認することができました。


本研究で用いた金微粒子は細胞へ影響を与えることなく、良好な状態での観察を行うことができます。この技術により細胞膜・細胞接着面で起きる様々な反応、分子の動きを捉えられることが期待されます。
玉田・岡本研究室では他大学や九州大学の他研究室との共同研究が盛んに行われています。今回の研究を行うために、私は広島大学医学部皮膚科学・柳瀬雄輝先生の元へ実験に行きました。そこで、本研究室では学ぶことのできない細胞の扱いを知ることができました。 自分の所属する研究室(私の場合は化学)とは異なる専門(生物)をもつ先生と共同研究することで、専門ではない知識を得ることができます。
自分の所属する研究室(私の場合は化学)とは異なる専門(生物)をもつ先生と共同研究することで、専門ではない知識を得ることができます。
Note:
より詳しく知りたい方は・・・