


免疫の過剰な応答は、アレルギーや炎症反応を引き起こします。私たちの体には免疫応答を厳密に制御する機構が備わっています。生体高分子学研究室の槇光輝さんらの研究グループは、ショウジョウバエをモデル生物として、架橋酵素であるトランスグルタミナーゼ(TG)が免疫応答に重要な転写因子・NF-κBの一種であるレリッシュを架橋し、過剰な免疫応答を抑制する分子機構を明らかにしました。昆虫と哺乳類のNF-κB経路はよく似ているため、今回のショウジョウバエでの発見がヒトの炎症疾患の原因解明や治療につながることが期待されます。本研究成果はJournal of Biological Chemistryに掲載されました。
タンパク質同士の架橋[1]は、生物の体内で様々な反応を引き起こします。特に重要な架橋反応に血液凝固、創傷治癒、皮膚の角化、アポトーシスなどがあり、これらの反応はすべて酵素・トランスグルタミナーゼ(TG)によって行われます。TGが触媒としてはたらく反応は、タンパク質のグルタミン側鎖とリジン側鎖との間の共有結合形成です(図1)。
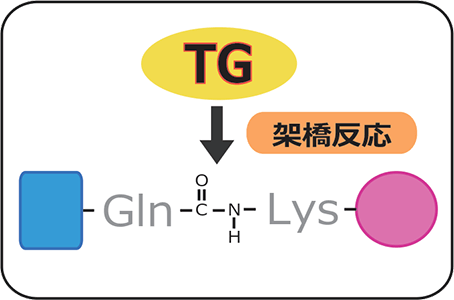
研究グループはこれまでに、TGが転写因子[2]・NF-κBの一種であるレリッシュを基質[3]とすることを明らかにしましたが、詳しい分子機構は未解明のままでした。そこで今回は、TGによるレリッシュの架橋様式を詳しく調べることで、免疫抑制の詳細な分子機構を明らかにすることを目的としました。
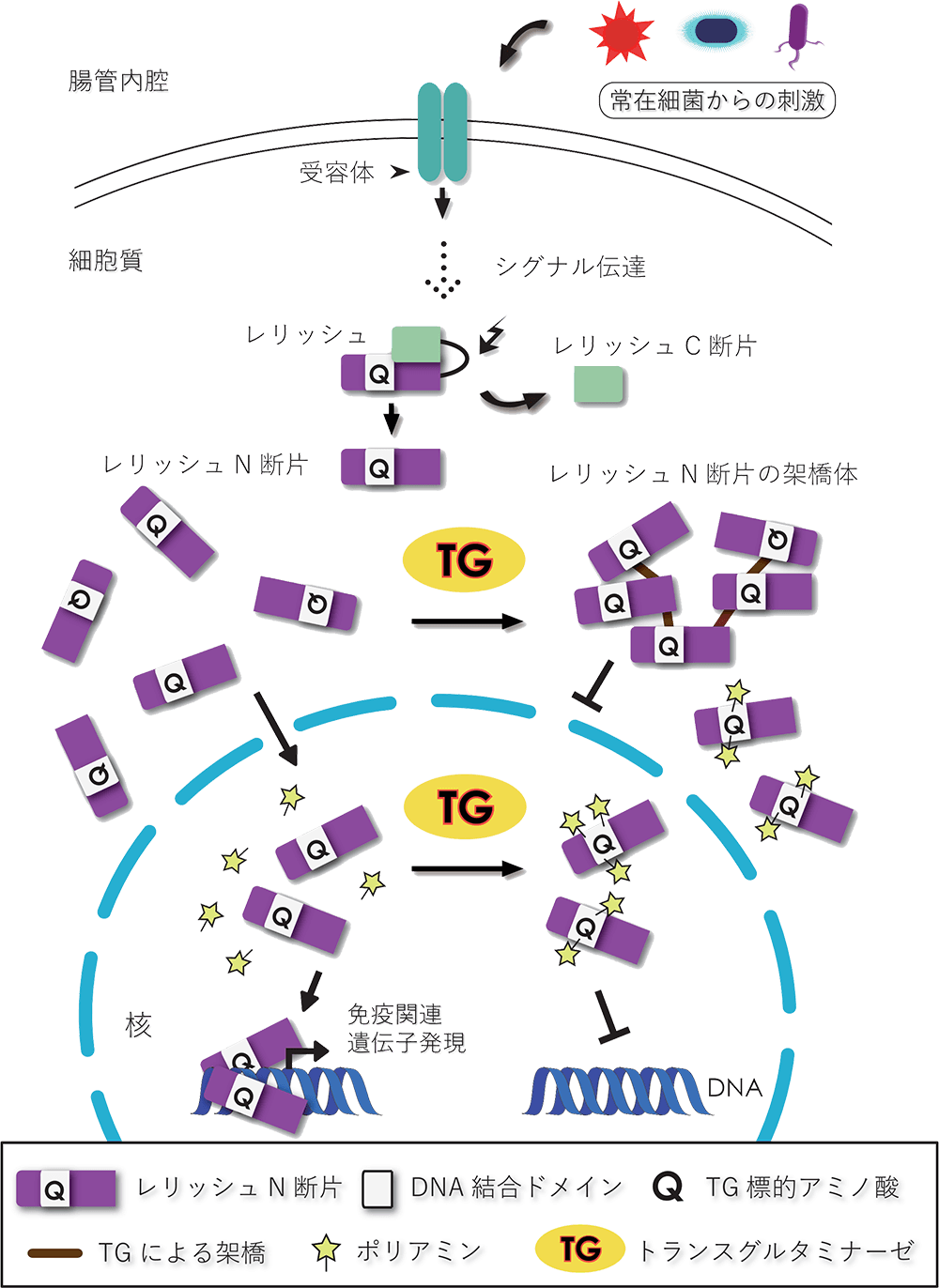
槇さんたちは組換え体タンパク質を用いた解析により、TGが架橋して新たな化学結合をつくるのは、レリッシュのDNA結合に重要な領域であることをつきとめました。このことから、TGがレリッシュのDNA結合力を変化させているのではないかと考えました。そこでTGを作用させる前後でレリッシュのDNA結合力を比べたところ、TGによる架橋反応を受けたレリッシュは結合力が低下していることがわかりました。
次にモデル生物であるキイロショウジョウバエを用いて、TGが生体内で実際にどうはたらいているかを解析しました(図2)。
まずTGのもうひとつの基質であるポリアミンを一部のハエに食べさせ、免疫応答に違いが生じるか調べました。するとポリアミンを食べさせたハエで、免疫応答の抑制が起きました。この免疫応答の抑制は、TGの遺伝子をノックダウン[4]したハエでは同じようにポリアミンを食べさせても起きなかったことから、TGによるポリアミンの架橋が免疫応答の抑制に効いていると結論付けました。
また、生体内で実際にレリッシュにポリアミンが架橋されていることもタンパク質解析により確かめられました。
ハエでもヒトでも、腸内細菌の刺激により免疫応答が活性化しますが、必要以上の過剰な応答はアレルギーや炎症反応と呼ばれます。これらを防ぐ抑制機構の一つとして、TGによる架橋反応があると考えられます。本研究により、TGはレリッシュのDNA結合に重要な領域を架橋し、転写因子としての機能を抑制していること、また、TGの基質となるポリアミンがレリッシュに架橋され、免疫応答の抑制に効いていることがわかりました(図3)。

学術論文は一般に、査読者と呼ばれる複数の科学者によって、実験や解析が科学的に正しい手続きで行われたか、出てきた結果が今までに知られていない新発見か、著者たちが結果を適切に解釈しているか(別の解釈の余地がないか)などを審査されます。論文を世に出すためには査読者からの指摘にこたえる必要があり、文章の書き換えだけでなく追加の実験をすることもあります。今回の研究は最初、試験管内でどのような反応が起こったか(記事の前半)を書いたものを投稿したのですが、査読者から生体内での解析データ(記事の後半)を要求されました。大掛かりな追加実験になりましたが、様々な試行錯誤を行い、いろんな人と議論しアイディアをもらいながら、結果を得ることができました。
Note:
より詳しく知りたい方は・・・