

海水中に飲料水の基準値を超えて含まれるホウ素が、膜を使って淡水化する際にどの程度漏れ出したかを分析する簡易で無害な手法が開発された。装置が高価であったり有害な水銀電極が必要であるというこれまでの分析法の問題を解決した。化学部門の藤森博士研究員らがElectroanalysisに発表した。
原子番号5のホウ素は自然界に広く分布しており、海水中に約5ppm、天然水中に1ppm以下で存在している。ホウ素は人が過剰に摂取した場合に毒性を示すため、日本では上水中のホウ素濃度を天然水と同じ1ppm以下にするように基準値が設けられている。
近年の水需要の増加から海水の淡水化が注目されているが、方法によってはホウ素が淡水化用の膜を漏れ出て、基準値を超えてしまうことがある(図1)。
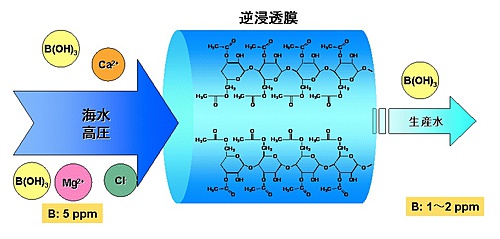
そのため、安全な海水淡水化技術を確立するためには、淡水化された水にどれくらいホウ素が漏れ出たかが測定できなければならない。
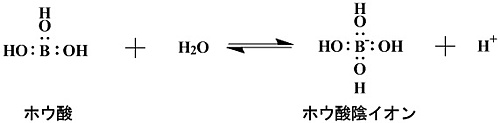
ホウ素は、水中ではその大部分がホウ酸分子とホウ酸陰イオンとして存在する(図2)。そのため、水中のホウ素を定量するためにはホウ酸濃度を測定する必要がある。
ホウ酸濃度の測定法には、ICP-AES(誘導結合プラズマ−発光分析法)やアゾメチンH吸光光度法、ポリオール錯体を用いた電気化学的定量法などがある。
このうち、ICP-AES装置は高価で大型なので、複数箇所にある海水淡水化プラントすべてに設置することは難しく、アゾメチンH吸光光度法は装置は小型であるが反応に使うアゾメチンHが分解しやすく取り扱いが複雑であるという欠点がある。
一方、電気化学的定量法も、装置は小型で簡易な手法であるが、分析に用いる電極が有害な水銀であるため実用化が難しかった。
藤森研究員らのグループは、電気化学的定量法を改良すべく、分析能力は優れているが有害である水銀電極に変わり、無害な炭素電極を用いてホウ酸濃度の測定を試みた。
電気化学的定量法は、ホウ酸が水酸基を複数もつポリオールという化合物と結合して錯体をつくる性質を利用する。ホウ酸とポリオールが含まれる水溶液中では、ポリオール単体とホウ酸–ポリオール錯体の両方が存在し、その割合はホウ酸の濃度によって変化する。この水溶液に電位をかけると、ポリオール単体とホウ酸–ポリオール錯体のそれぞれが酸化反応を起こし電流が流れる。
ホウ酸–ポリオール錯体はポリオール単体より安定しているため酸化反応を起こす電位が高い。そのため、ホウ酸の濃度が高くホウ酸–ポリオール錯体の割合が多いと、高い電圧をかけたときに流れる電流の量が多くなる。逆に、ホウ酸の濃度が低くポリオール単体の割合が多いと、低い電圧の時に流れる電流の量が多くなる。この電圧と電流値の関係の変化を観測することで間接的にホウ酸濃度の測定が可能となる。
本研究では、ポリオールの一種であるタイロン(4,5-ジヒドロキシベンゼン-1,3-ジスルホン酸)を用いた。タイロンとホウ酸を含む水溶液に、炭素電極で電位をかけて流れた電流値を測定したところ図3のようになった。
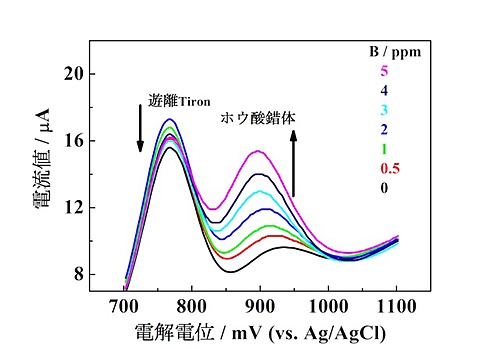
ホウ酸濃度が低い場合はタイロン単体の割合が高いため、750mVで大きな電流が観測されるが、ホウ酸濃度が増加するとホウ酸–タイロン錯体の割合が増え、900mV付近での電流値が増加した。この電流値の変化を解析することでホウ酸の濃度を決定することが可能となった。
藤森研究員は「簡易で無害なホウ素の定量法が確立されたことで、生産水の品質管理が容易になった。現在は高効率かつ環境への負荷が低いホウ素除去剤の開発を目指して研究を行っている」と話す。
藤森研究員に今回の研究で苦労した点をお聞きしました。
「ホウ素を測定する従来の方法にアゾメチンHとホウ酸の錯体生成を用いた分光学的手法がありますが、この化合物は時間とともに分解してしまうため測定には厳密に時間を決める必要があります。実際に私もアゾメチンH法を用いて今回の電気化学的手法との比較を行いましたが、操作が複雑で毎回の測定で苦労しました。」
——そこで扱いやすい電気化学的定量法を用いたのですね?
「はい。しかし、金属イオンであれば電気分解を用いた分析ができますが、ホウ素は電気化学的に不活性であるためホウ酸を電気分解することはできません。そこで、電気分解できる有機物との錯体を分析に利用することにしました。」
——その際、苦労されたことは?
「錯体が安定に存在するpH領域の見積もりは、これまでの研究結果から計算することができましたが、その結果、弱アルカリ性条件を一定に保たなければならないことが分かりました。そこで、弱アルカリ性にすることができるさまざまな緩衝溶液でホウ素の定量を行ったところ、リン酸でのみ実験がうまくいきました。その理由を調べたところ、電極表面付近のpHが溶液とは異なり高くなっていることが分かってきました。」
より詳しく知りたい方は・・・